Chemie Allgemein
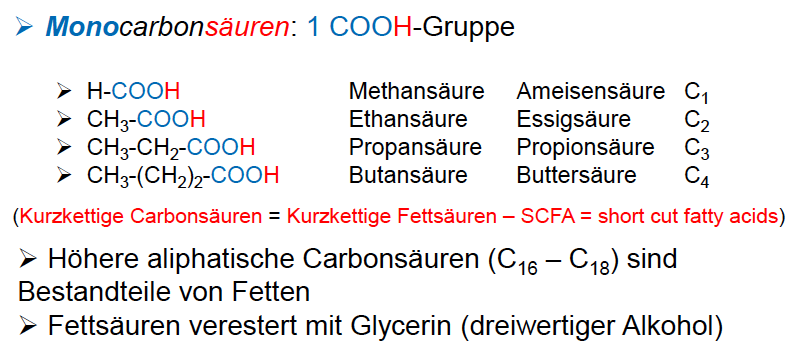
Carbonsäuren
R-COOH
- organische Säuren
- Acidität wird durch die Substituenten im Alkylrest beeinflusst
- können (bis auf Ameisensäure - mit Tollens nachweisbar) nicht weiter oxidiert werden
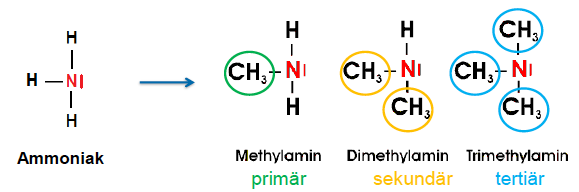
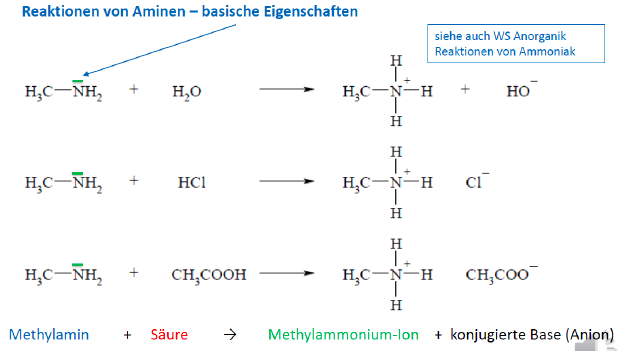
Amine
- Derivate des Ammoniaks
- Stufenweiser Austausch der H-Atome des NH3s mit organischen Resten
- analog zum Ammonium-Ion können 4 H-Atome auch durch 4 org. Reste am N-Atom substituiert werden
- Harnstoff: Diamid des Kohlenstoffs
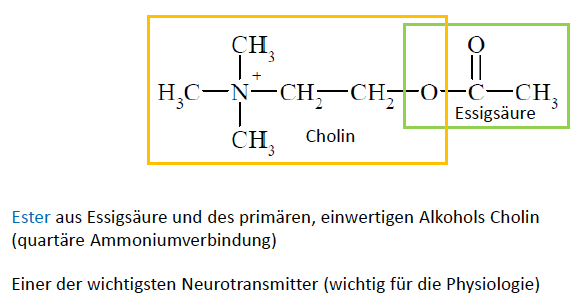
Cyclische Amine:
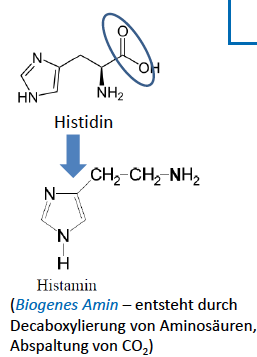
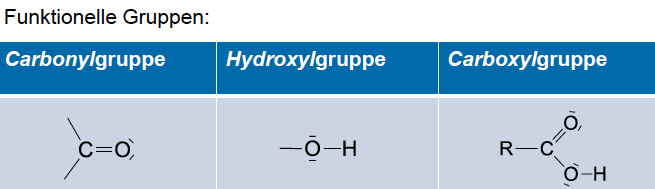
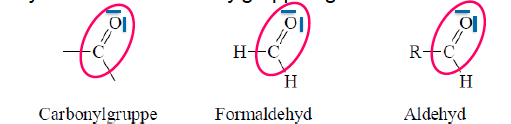
Carbonylgruppe
C=O
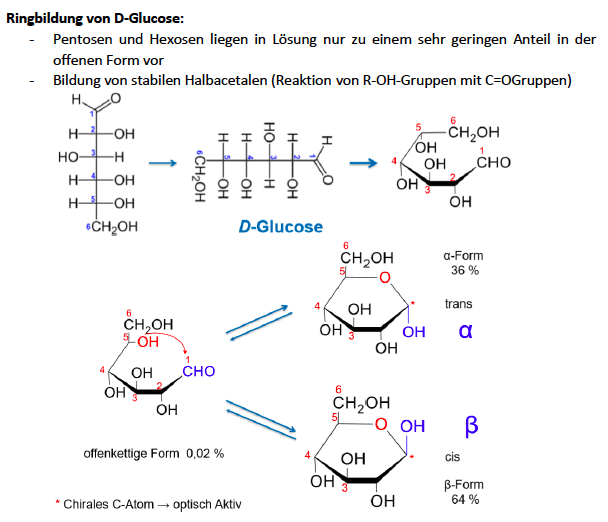
Ringbildung bei Glucose und Fructose
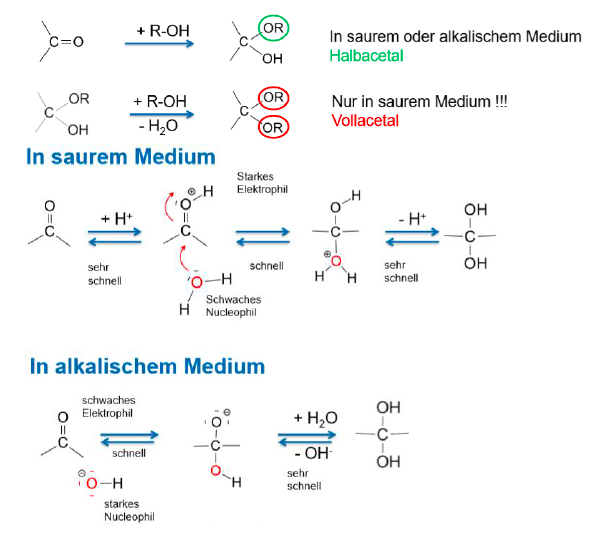
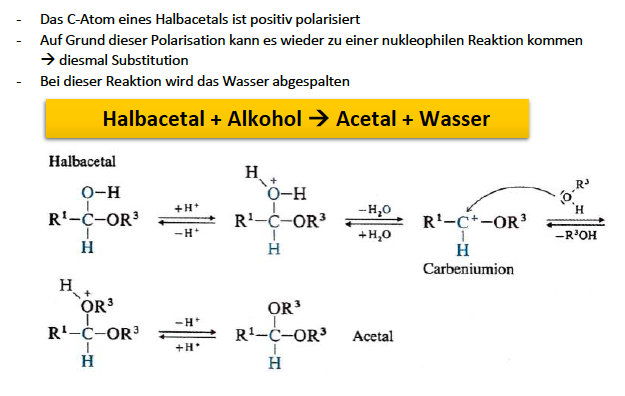
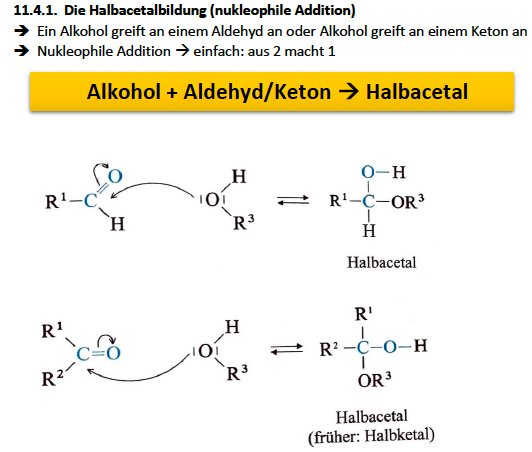
Grundlage ist die Bildung von Halb- und Voll-Acetalen
liegen als cyclische Halbacetale eher vor als als offenes System
Redox-Reaktionen
- Elektronen werden übertragen



Ether
- Allg. Formel: R-O-R
- Derivate des Wassers
- 2 gleiche Alkylreste bilden einfache (symmetrische) Ether
- 2 unterschiedliche Alkylreste bilden gemischte (unsymmetrische) Ether
- Nomenklatur: durch Voranstellung der Namen der Alkylreste in alphabetischer Reihenfolge vor den Ether
- bilden durch Autooxidation Peroxide, die sehr explosiv sein können
Pentan
5
C5H12
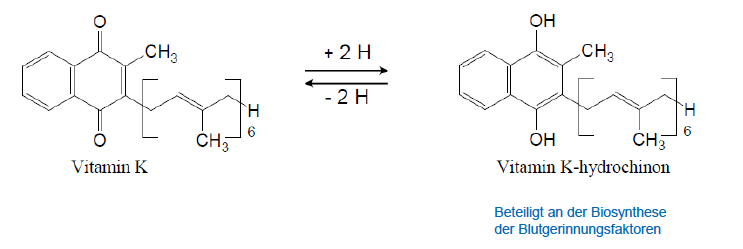
Chinone
- Oxidationsprodukt von Aromaten
- keine aromatischen Eigenschaften, da an 2 C-Atomen die Substituenten durch Sauerstoff in einer Doppelbindung ersetzt sind
M-Effekt
mesomerer Effekt
- beschreibt die Fähigkeit eines Substituenten zusammen mit dem Ring mesomere Strukturen auszubiden, kann also ein Elektronenpaar in ein Rinsystem schieben
- M-Effekt überwiegt dem I-Effekt
- Erstsubstituenten, die ihre freien Elektronenpaare in die Mesomerie des Ringes einbringen (+M-Effekt) dirigieren den Zweitsubsituenten in ortho- oder para-Stellung
- Erstsubstituenten, die ihre freien Elektronenpaare nicht in die Mesomerie des Ringes einbringen (-M-Effekt) dirigieren den Zweitsubstituenten in meta-Stellung
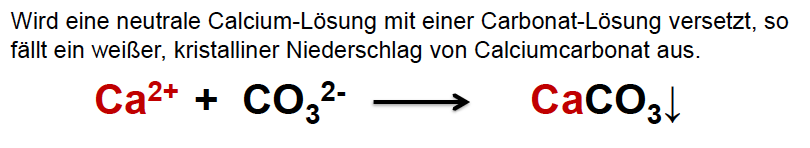
Nachweis von Calcium - Ausführlich
- rote Flammenfärbung

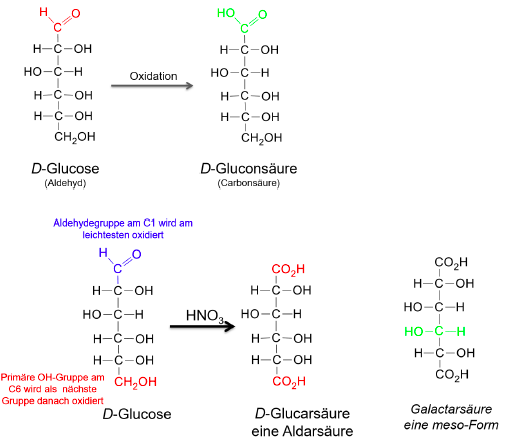
Aldosen
Aldehydgruppe an den C-Atomen der Kohlenhydrate
Oxidation von Aldosen:
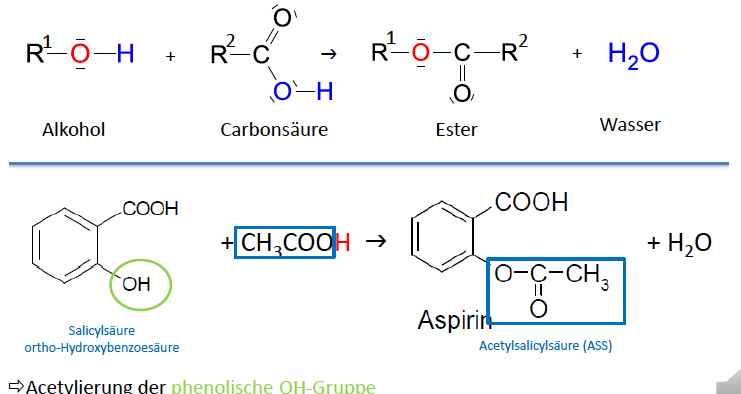
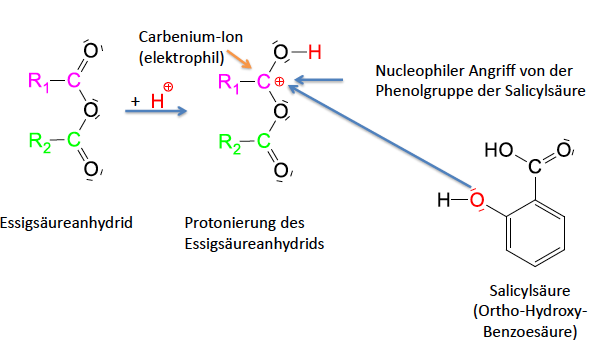
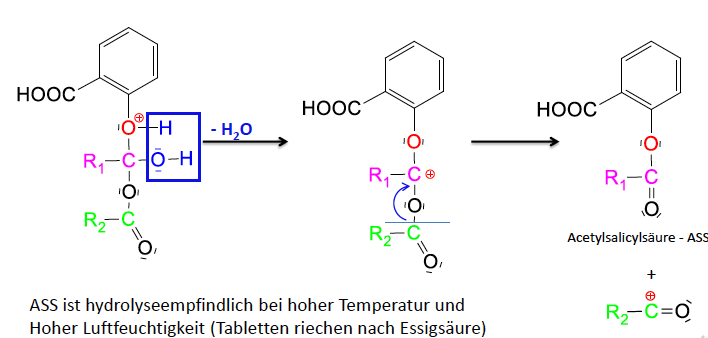
Synthese Acetylsalicylsäure

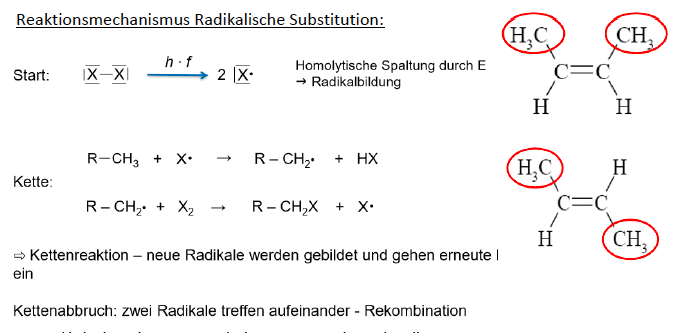
Radikalische Substitution
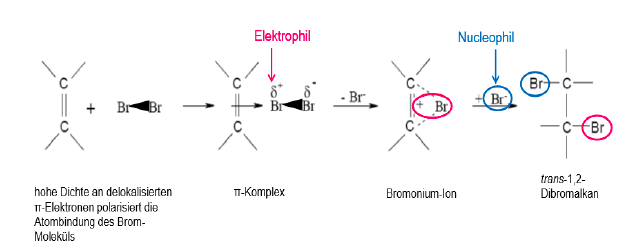
Elektrophile Addition an Doppelbindungen
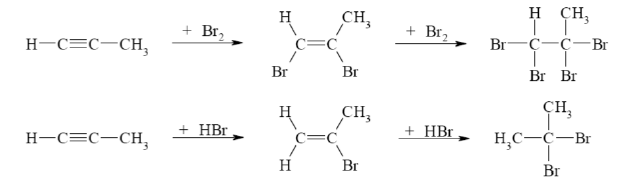
Durch Doppelbindungen kommt es in Ggw von Br2 zu einer Polarisierung. Die Doppelbindung stößt die gleichsinnig geladene Elektronenwolke des Br-Br-Moleküls ab. Dies bewirkt seine Polarisierung, eine positive und eine negative Partialladung entstehen. So bilden sich theoretisch ein elektrophiler und ein nucleophiler Teil. Die Polrisierung nimmt so stark zu, dass der elektrophil-positive Teil des Br2 unter Bildung eines cyclischen Komplexes, dem Bromonium-Ion, auf die Doppelbindung übertragen wird. Dieser Schritt hat die Aktivierungsenergie soweit herabgesetzt, dass die Reaktion vergleichsweise schnell ablaufen kann. Nach der Übertragung bleibt eine positive Teilladung am anderen C-Atom zurück, sodass das zuvor entstandene Nucleophil (Br-) dort angreifen kann.
Regel nach Markownikow:
Tragen die beiden Kohlenstoffatome der Doppelbindung eine unterschiedliche Anzahl an H-Atomen, so wandert das Halogen bevorzugt an das wasserstoffärmere Kohlenstoff-Atom.
Berechnung der Stoffmengenkonzentration

Hückel-Regel
monocyclische, planare Molekülsysteme zeigen aromatischen Charakter, wenn
4n + 2 delokalisierte Elektronen vorhanden sind
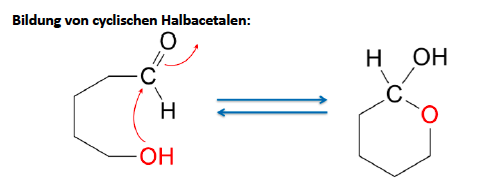
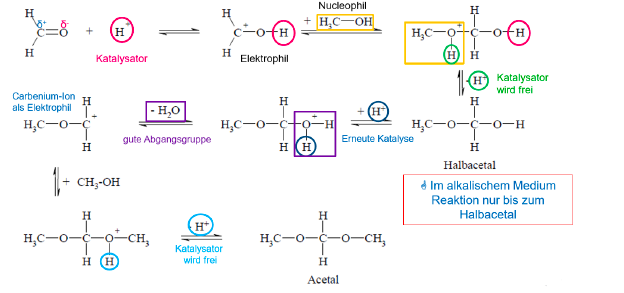
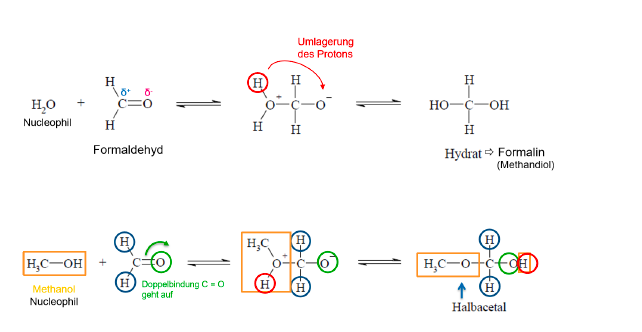
Acetalbildung
Eigenschaften Alkane
- 4 Einfachbindungen sp3-hybridisiert
- CnH2n+2
- Endung: -an
- bevorzugte Reaktionsart: Radikalische Substitution
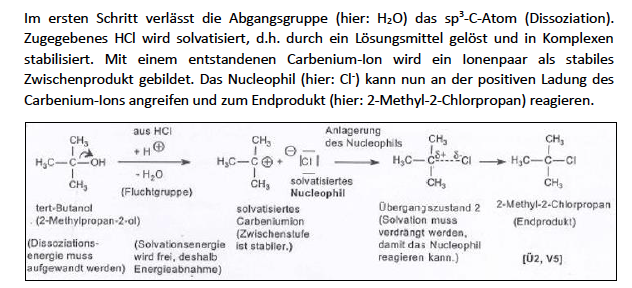
Darstellung von tertiären-Halogenalkanen
durch SN1-Reaktion
cis (Z) - Isomere und trans (E) - Isomere
cis / Z:
- beide Substituenten liegen auf der gleichen Seite
trans / E:
- die Substituenten liegen auf entgegen gesetzten Seiten
Ethan
2
C2H6
Kohlenhydrate Allg.
CnH2nOn
- Energielieferant
- 
Synproportionierung
von niedriger und hoher Oxidationszahl zu mittlerer Oxidationszahl
Alkine
- Dreifachbindungen
- sp-hybridisiert
- CnH2n-2
- Suffix: -en
- bevorzugte Reaktion: elektrophile Additionsreaktion zu Halogenalkanen
Aminosäuren
- Grundlage für Proteine
- 21 AS
- Bausteine der Peptide
- aus Aminogruppe und Carboxylgruppe
- Amphotere Eigenschaften
- Van-Slyke-Reaktion
- Nachweis AS: elektrophoretische Methode und Dünnschichtchomatographie
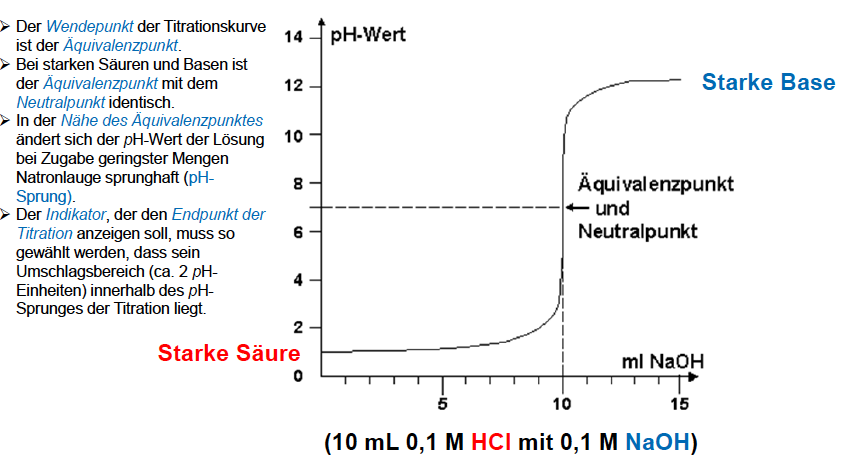
Titrationskurve Säure-Base
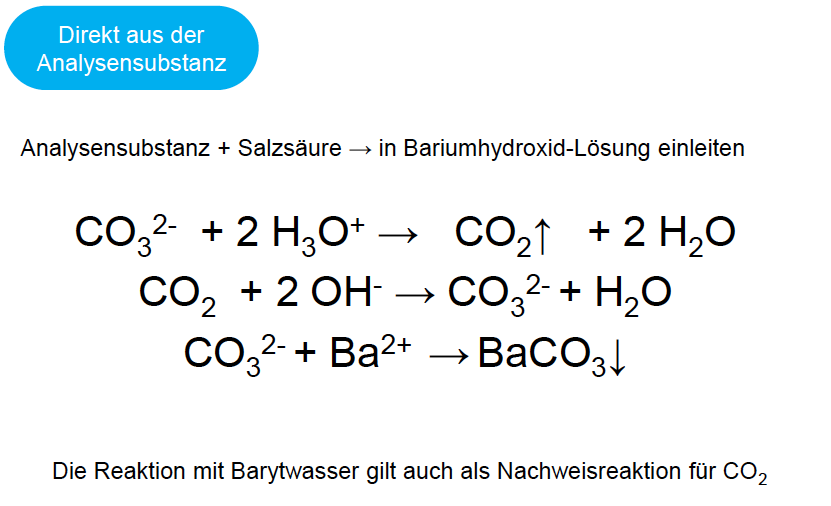
Carbonat-Nachweis
Anfangs pH schwache Säuren
pH = 1/2 x (pKs - lg c)
nucleophil
- kernliebende Teilchen, negative oder partiell negative Ladung bzw hohe Elektronendichte
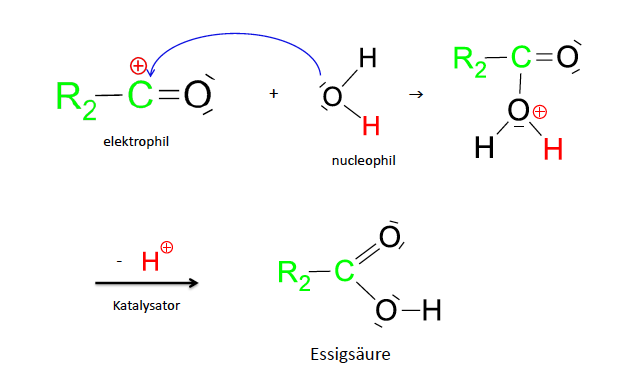
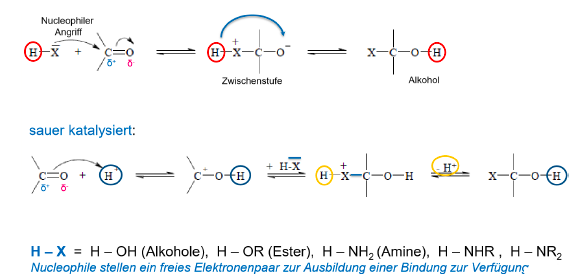
Elektrophile Addition Aldehyde
Bildung eines Halbacetals
Äquvalenzpunkt schwache Basen
pH = 1/2 x (pKS – lg c)
Puffer
- sorgen dafür, dass sich trotz Zu- oder Abgabe von Protonen der PH-Wert sich nicht groß verändert
- immer schwache Säure und konjugierte Base oder schwache Base und konjugierte Säure

Konstitutionsisomere
gleiche Summenformel aber unterschiedliche Strukturformeln
cis Isomere: Substituenten auf der derselben Seite
trans-Isomere: Substituenten auf gegenüberliegenden Seiten
Äquivalenzpunkt schwache Säuren
pH = 1/2 x (14 + pKs + lg c)
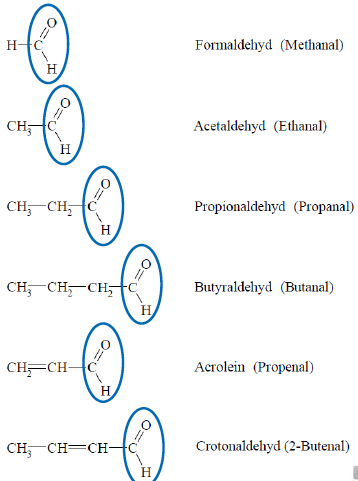
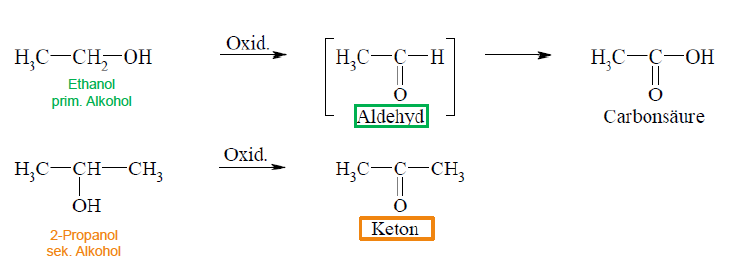
Aldehyde
- entstehen bei Oxidation von primären Alkoholen
- funktionelle Gruppe: polare Carbonylgruppe -CHO
- H-Atom und ein Alkylrest an die Carbonylgruppe gebunden
- Kohlenstoff kann durch ein Anion nucleophil angegriffen werden
- Sauerstoff kann durch ein Kation elektrophil angegriffen werden
- reaktionsfreudig, unbeständig, bilden in Abhängigkeit von pH-Wert und Temperatur unwirksame Additions-/Polymerisationsprodukte
- Aldehyde reagieren mit Amino-(NH2), Thiol-(SH), Carboxyl-(COOH), Hydroxid-(OH) und/oder Sulfhydrylgruppen in zellulären Eiweißmolekülen und Nucleinsäuren und führen zur Denaturierung
- Formalin wird durch die starke Denaturierung der Eiweiße zur Organ-und Gewebekonservierung in der Anatomie und Pathologie eingesetzt
Nachweis von Nitrit-Ionen
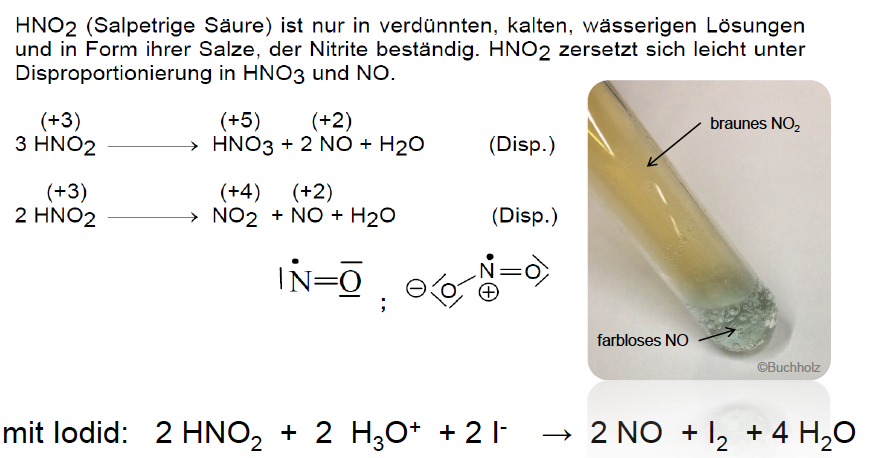
ODER: Nachweis von Nitrit durch Lungens-Reagenz
Iodoformreaktion
Halogenierung von Alkoholen:

Cycloalkane
gesättigte, ringförmige Wasserstoffe
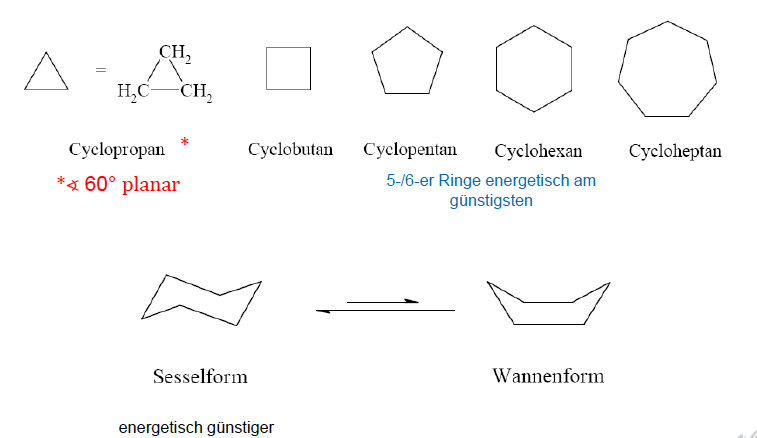
- in beiden Konformationen gibt es äquatoriale (e), in der ebene liegende, und axiale (a) aus der Ebene heraus stehende Atome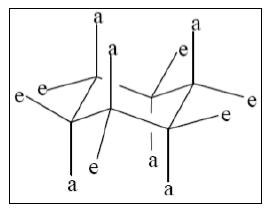
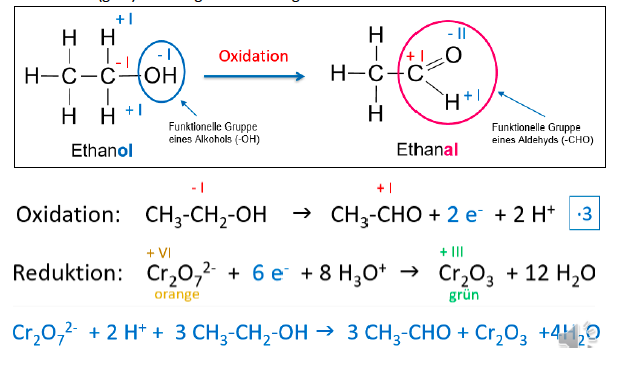
Alkoholtest
in Anwesenheit von Ethanol wird hier durch die Reduktion von Dichromat (orange) zu Chromoxid (grün) bestätigt, gleichzeitig wird das Ethanol zu Ethanal oxidiert
Säure-Base-Theorie nach Bronstedt
Säure: Protonendonator, kann H+ abgeben
Basen: Protonenakzeptoren
Berechnung molare Masse (M)
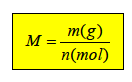
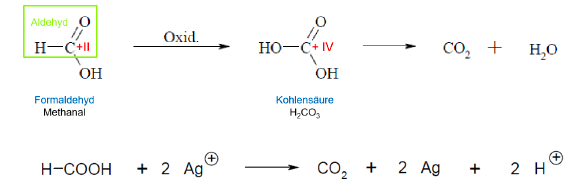
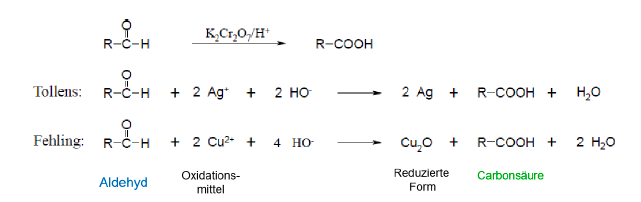
Oxidation von Carbonsäuren
nicht möglich bis auf Ameisensäure, bei Oxidation entsteht Kohlensäure bzw Kohlenstoffdioxid
Hexan
6
C6H14
Typische Reaktionen von Alkoholen
1. Oxidation eines primären Alkohols --> Aldehyd --> Carbonsäure
2. Oxidation eines sekundären Alkohols --> Keton
3.Oxidation eines tertiären Alkohols --> KEINE Oxidation, aber nucleophile Substitution möglich
Nachweis von Barium
- grüne Flammenfärbung
Chemische Eigenschaften Amine
-Primäre Amine reagieren mit Diazoniumsalzen, die sich in GGww von Wasser und N2-Entwicklung Alkohole bilden 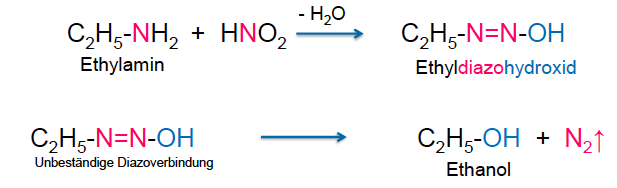 - sekundäre Amine bilden mit HNO2 unter Wasserabspaltung beständige Nitrosamine, die Krebserregend sind!!!
- sekundäre Amine bilden mit HNO2 unter Wasserabspaltung beständige Nitrosamine, die Krebserregend sind!!!
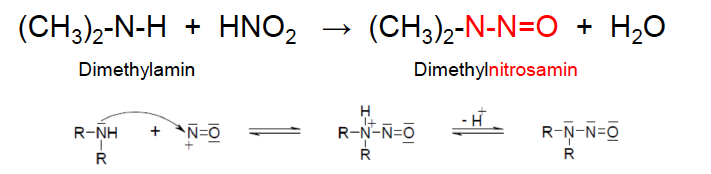 - tertiäre Amine reagieren unter Normalbedingungen nicht mit HNO2
- tertiäre Amine reagieren unter Normalbedingungen nicht mit HNO2
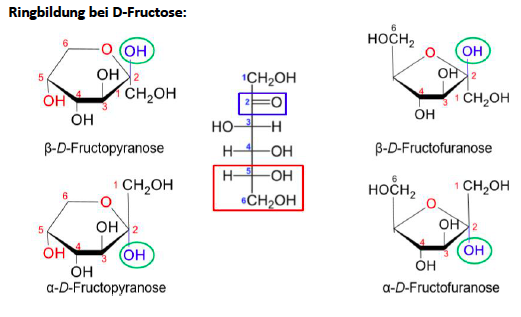
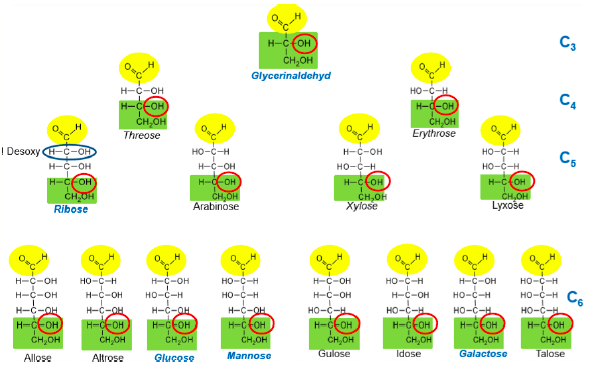
Monosaccharide
- einfachste Kohlenhydrate
- Polyhydroxyaldehyde --> Aldosen --> Aldehydfunktion
- Polyhydroxyketosen --> Ketosen --> Ketogruppe
- viele OH-Gruppen - gut Wasserlöslich
- süß
- enthalten neben Carbonyfunktion 2 - 7 Hydroxylgruppen
- Triosen - Octosen
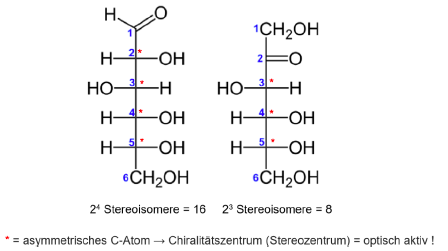

* = asymmetrisches C-Atom
--> Optische Aktivität, können linear polarisiertes Licht um einen bestimmten Winkel drehen
Milchsäure Enantiomere

Vitamin C Synthese
Ascorbinsäure
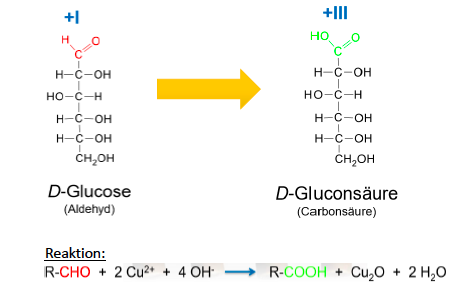
Oxidation von Glucose zu D-Glucoronsäure, kann Vitamin C bilden
I-Effekt
Induktiver Effekt
- Beschriebt die Eigenschaft des Erstsubstituenten, Elektronen in den Ring zu schieben bzw. diesem zu entziehen und hängt von der Elektronegativitätsdifferenz zwischen dem C-Atom und dem Substituenten ab
- Substituenten die Elektronen entziehen, vermindern die Chance einer Zweitsubstitution (-I-Effekt)
- Substituenten, die Elektronen liefern, erhöhen die Chance einer Zweitsubstitution (+I-Effekt)
Fette und Öle
Esther höherer Carbonsäuren mit einem dreiwertigen Alkohol, Glycerin
- je mehr Doppelbindungen, desto flüssiger das Öl
Halbacetalbildung (Nucleophile Addition)
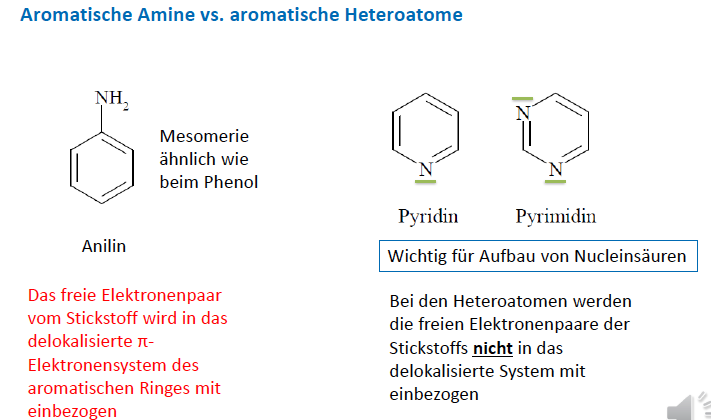
Aromaten
- ungesättigte, ringförmige Kohlenwasserstoffe
- Grundstruktur: Benzol C6H6, neue Bezeichnung Benzen
--> &-Ring mit 3 Doppel- & 3 Einfachbindungen, konjugiert angeordnet
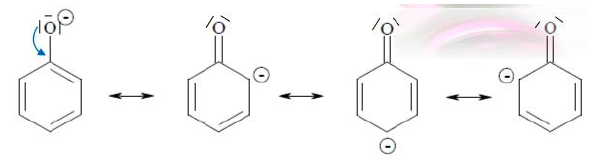
Phenole
- schwach saurer Charakter, z.B. in GGw von NaOH
- entehen beim verkochen von Diazoniumsalzen
- I- und M- Effekt
- 4 mesomere Grenzstrukturen:
Butan
4
C4H10
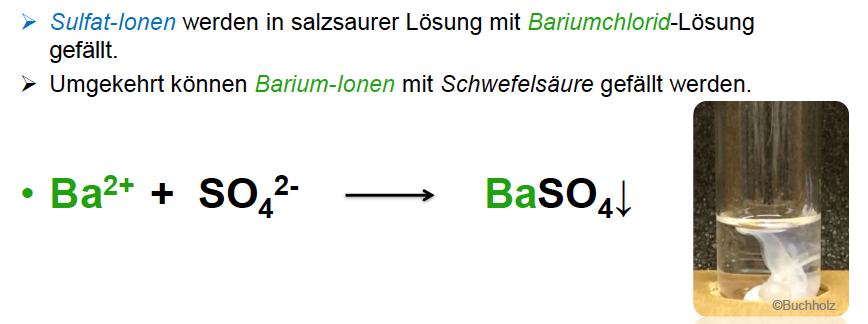
Nachweis von Sulfat-Ionen

elektrophil
elektronenliebende Teilchen, positive oder partiell positive Ladung
pH-Wert Berechnung von Säurekonzentration aus
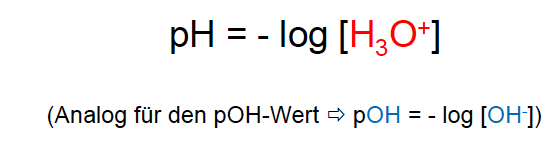
Peptide und Proteine
- zwei AS bilden unter Wasserabspaltung eine amidartige Bindung aus --> Peptidbindung
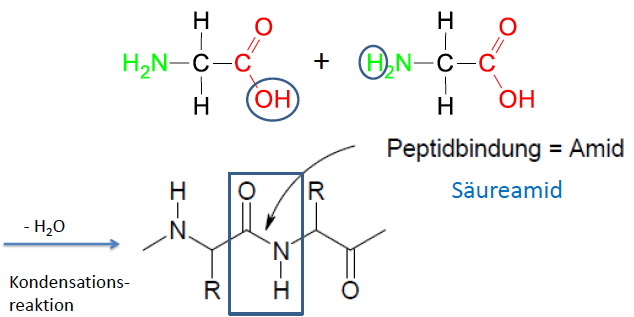
- Peptidbindung: Doppelbindungscharakter durch Mesomerie, planar
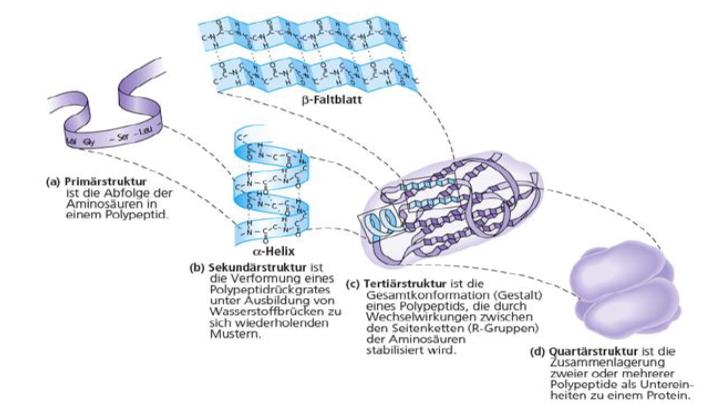 - Biuret-Reaktion zum Nachweis auf Eiweiße (Eiweißlösung reagiert mit verdünnter Kupfersulfatlösung und NaOH zu einem rot-violetten Kupferkomplex
- Biuret-Reaktion zum Nachweis auf Eiweiße (Eiweißlösung reagiert mit verdünnter Kupfersulfatlösung und NaOH zu einem rot-violetten Kupferkomplex
- Denaturierung verändert die Struktur eines Proteins
Anfangs pH-Wert schwache Basen
pH = 1/2 x (14 + pKs + lg c)
Methan
1
CH4
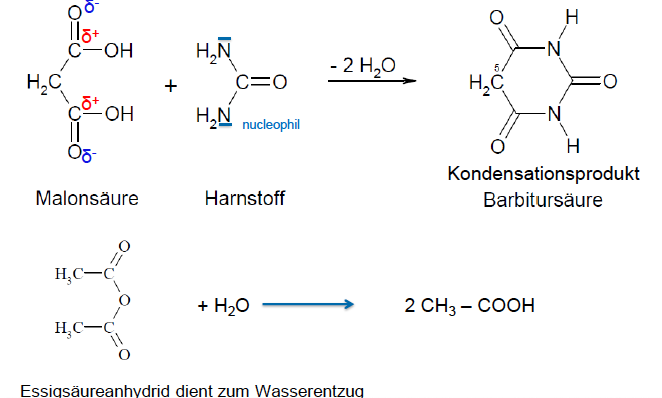
Darstellung von Babitursure
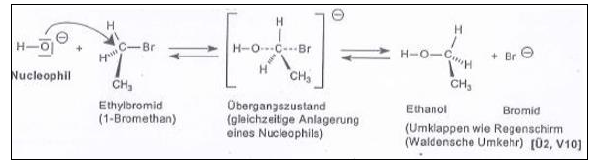
Darstellung von primären Alkoholen
Durch SN2-Reaktion

Steran
Grundgerüst für alle Steroidhormone
z.B: Glucocorticoide und Sexualhormone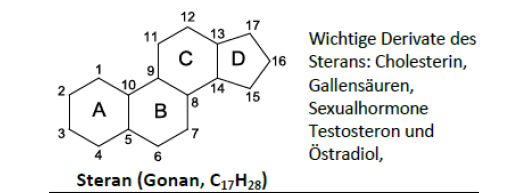
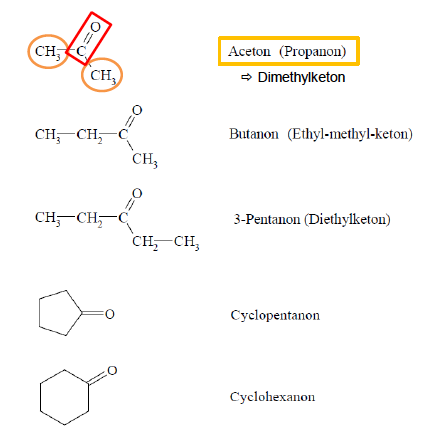
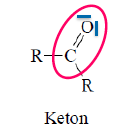
Ketone
- entstehen bei Oxidation von sekundären Alkoholen
- zwei Alkylreste an die Carbonylgruppe gebunden
- werden im katabolen Stoffwechsel bei Hungerzustand gebildet, Anstieg kann zur Ketose führen
- Keto-Enol-Tautomerie
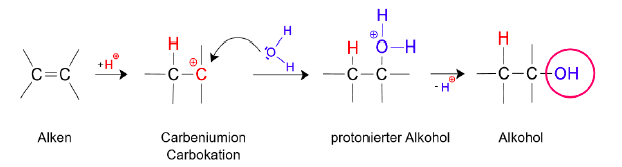
Hydratisierung - Entstehung von Alkohol
- nucleophile Addition von Wasser an Alkene
- Katalysator
- Alken verbindet sich mit einem Proton, Doppelbindung klappt dabei aus, um die Bindung mit dem H-Atom zu ermöglichen, gleichzeitig entsteht dadurch am anderen C-Atom eine positive Partialladung.
- an das so entstandene Carbenium-Ion oder Carbokation greift nun ein Wassermolekül an.
- vom protonierten Alkohol wird ein Proton abgespalten
--> so ist der Alkohol mit seiner charakteristischen funktionellen OH-Gruppe entstanden
Isomerie
Verbindungen der gleichen Summenformel aber mit unterschiedlichen Strukturen
Propan
3
C3H8
Zusammenhang pH und pOH
pH + pOH = 14
Thiole
- Thioalkohole
- R-CH2-SH (Thiol)
- Derivate des Wassers bzw. Schwefelwasserstoffs (H2S)
- Typ. Reaktion: Disulfidbildung durch Oxidation
- stärker sauer als Alkohol
- werden Thiole oxidiert bilden sie sog Disulfide
Additionsreaktionen an der Carbonylgruppe
Konstitutionsisomere
gleiche Summenformel, unterschiedliche Eigenschaften
Oxidation von Aldehyden
- dient zum Nachweis von reduzierenden Eigenschaften von Verbindungen
- Aldehyde sind oxidierbar, bei der Oxidation entstehen Carbonsäuren
- Oxidationsmittel: Kaliumdichromat, Ag+- und Cu2+-Ionen
- Nachweisreaktionen laufen nur im alkalischen Medium ab
Alkene
- mindestens eine Doppelbindung = funktionelle Gruppe
- sp2-hybridisiert (1 x sigma, 1x pi Bindung)
- planar, nicht frei drehbar
- reaktionsfreudiger als 1-fach-Bindung --> bevorzugte Reaktion: Addition (elektrophil)
- Nachweis: für Alkene bzw Doppelbindungen in einem Molekül: Entfärben einer Bromlösung
- CnH2n
- Suffix: -en
Ammonium Nachweis

Eigenschaften Ether
- Derivate des Wassers, bei dem beide H-Atome durch Alkylreste ausgetauscht werden
- Symmetrische und unsymmetrische Ether
- leicht entflammbar
- bilden explosive Peroxide
Massenwirkungsgesetz
beschreibt die Lage des chemischen Gleichgewichtes
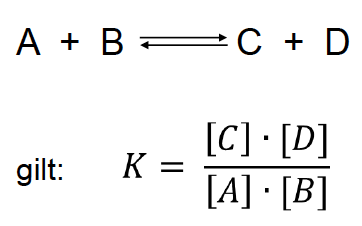

Nachweis Na+
gelbe flamme
Einteilung Alkohole
Einwertig (1 x OH), Zweiwertig (2 x OH), dreiwertig (3 x OH)
--> mehrwertige Alkohole: Polyole
Fette und Öle
Ester höherer Carbonsäuren mit einem dreiwertigen Alkohol
Glycerin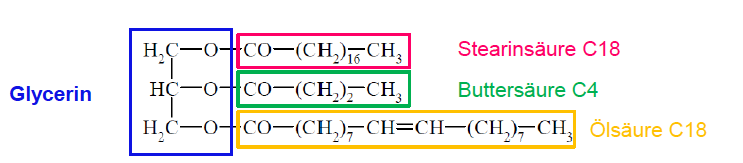 je mehr Doppelbindungen, desto flüssiger ist das Fett bzw Öl
je mehr Doppelbindungen, desto flüssiger ist das Fett bzw Öl
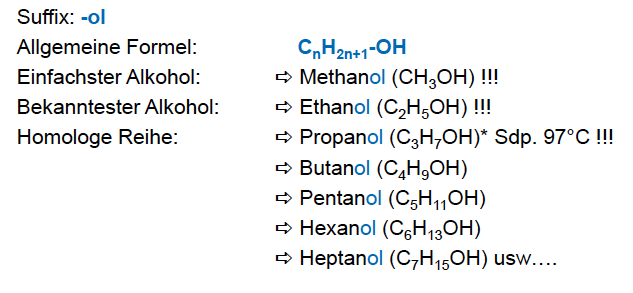
Alkohole
- Aliphatischer Kohlenwasserstoff + OH-Gruppe
- einfachster Alkohol: Methanol (CH3OH)
- bekanntester Alkohol: Ethanol (CH2H5OH)
- entstehen durch nucleophile Addition von Wasser an Alkene (Hydratisierung), dafür Katalysator nötig
- funktionelle Gruppe: -OH-Gruppe
- Suffix: -ol
- Stellung der Hydroxlgruppe wird durch eine vor den Stammnamen gesetzte Zahl gekennzeichnet, bei mehreren OH-Gruppen: Endsilbe -diol, -triol
- allg. Formel: CnH2n+1-OH
Nachweis von Chlorid-Ionen

Nachweis von Aldehyden
Tollens-Silberspiegelprobe
- sind im Gegensatz zu Ketonen oxidierbar und daher durch Oxidationsmittel nachweisbar
- es bildet sich schwarzer Niederschlag oder ein glänzender Spiegel aus elementarem Silber
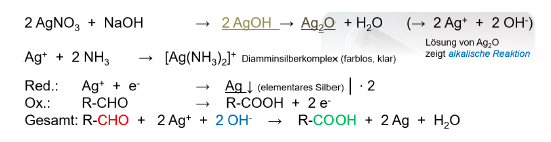
Fehlingprobe
- führt zu einem rötlichen Niederschlag aus Kuper(I)-Oxid
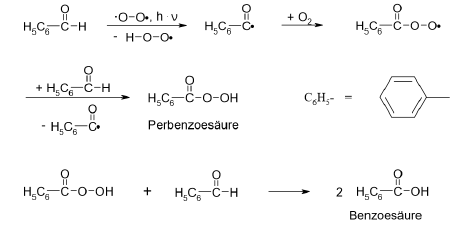
Autooxidation von Benzaldehyd
- während Oxidation entstehen Carbonsäuren
- Reaktion folgt einem Radikalkettenmechanismus
Henderson-Hasselbalch-Gleichung
pH = pKs + lg (Base / Säure)
Nachweis Kalium-Ionen
Vorprobe Flammenfärbung: violette Flamme durch Coblaltglas
elektrophile aromatische Substitution
- meist unter Anwestenheit eines Katalysators (z.B. Eisenbromid FeBr3)
- Ziel: Bildung eines starken elektrophils
- hohe Elektronegativität der Bromid-Ionen reicht aus um die Elektronen über die ganze Verbindung so an sich ran zu ziehen, dass das Brommolekül stark polarisiert wird und in Folge eine heterolytische Spaltung zum positiven Bromkation Br+ (elektrophil) und dem Eisen(III)bromid-Komplex (Fe(Br)4)- stattfindet
- Prinzip: Ein H-Atom wird durch ein anderes Atom oder einen Rest ersetzt. Der aromatische Charakter des Rings bleibt erhalten. Beispiele für diesen Mechanismus sind Nitrierung und Sulfonierung
Nitrierung:
- Nitrierung von Benzen erfolgt durch Nitiriersäure, Gemisch aus Salpetersäure und Schwefelsäure. Dabei wird zuerst das Nitronium-Ion (NO2+) als elektrophil gebildet. Die Schwefelsäure fördert die Abspaltung von Wasser
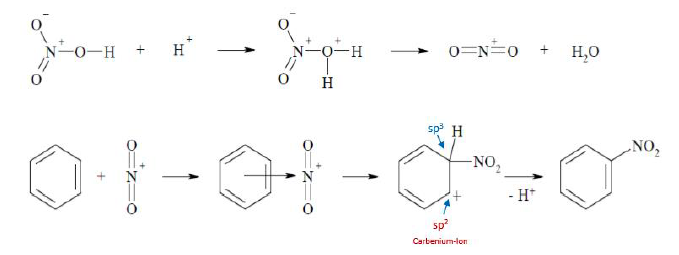 Sulfonierung
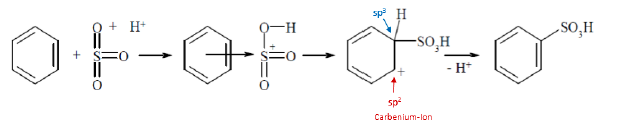
Sulfonierung
- durch Schwefeltrioxid, wobei Benzolsulfonsäure entsteht. Das HSO3+ ist das elektrophil
Nachweis von Nitrat-Ionen
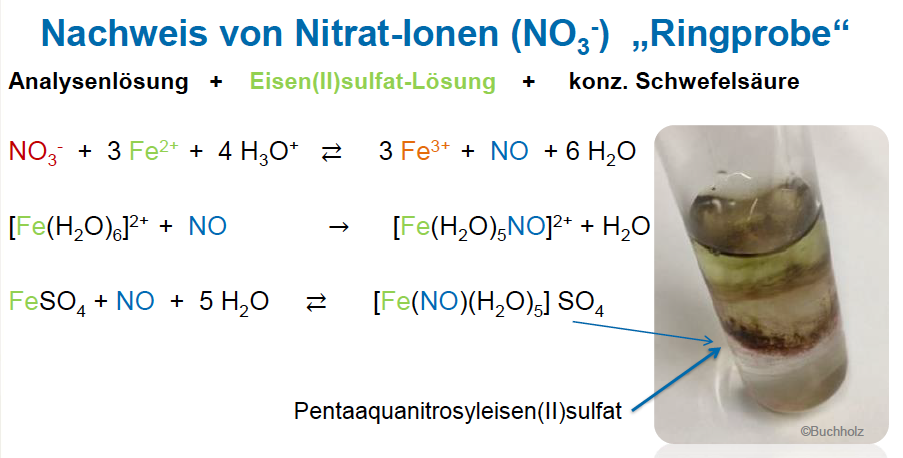 --> es wird ein brauner Ring im Reagenzglas gebildet
--> es wird ein brauner Ring im Reagenzglas gebildet
--> ACHTUNG: Analysensubstanz + HCL --> Bildung Nitroser Gase
--> ACHTUNG: Nachweis gestört durch Nitrit
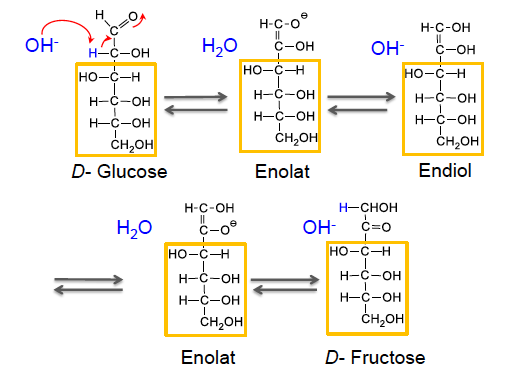
Keto-Enol-Tautomerie
Tautomerie:
- Isomere, die sich schnell ineinander umwandeln
- Isomere: Moleküle mit der selben Summenformel aber einem anderen Aufbau
z.B.: von D-Glucose zu D-Fructose
Paraffine
langkettige, flüssige Alkane
Komplexe
- aus Koordinationszentrum und Ligandenhülle
- Koordinationszahl (KOZ) = Anzahl der vom Zentralatom gebundenen Liganden
- häufig charakteristische Färbungen
- Nomenklatur:

Disaccharide
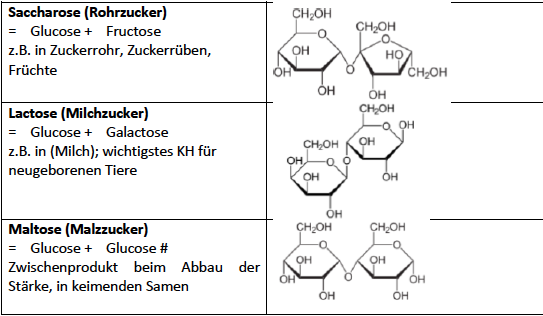
 Monosaccharide bilden mit Alkoholen unter Wasserabspaltung Glycoside. Ist der Alkohol selbst ein Monosaccharid entsteht ein Disaccharid
Monosaccharide bilden mit Alkoholen unter Wasserabspaltung Glycoside. Ist der Alkohol selbst ein Monosaccharid entsteht ein Disaccharid
--> Glycosidbildung nur im sauren Medium
Disproportionierung
Reaktion von mittlerer Oxidationszahl zu kleinerer und größerer Oxidationszahl