MedChem
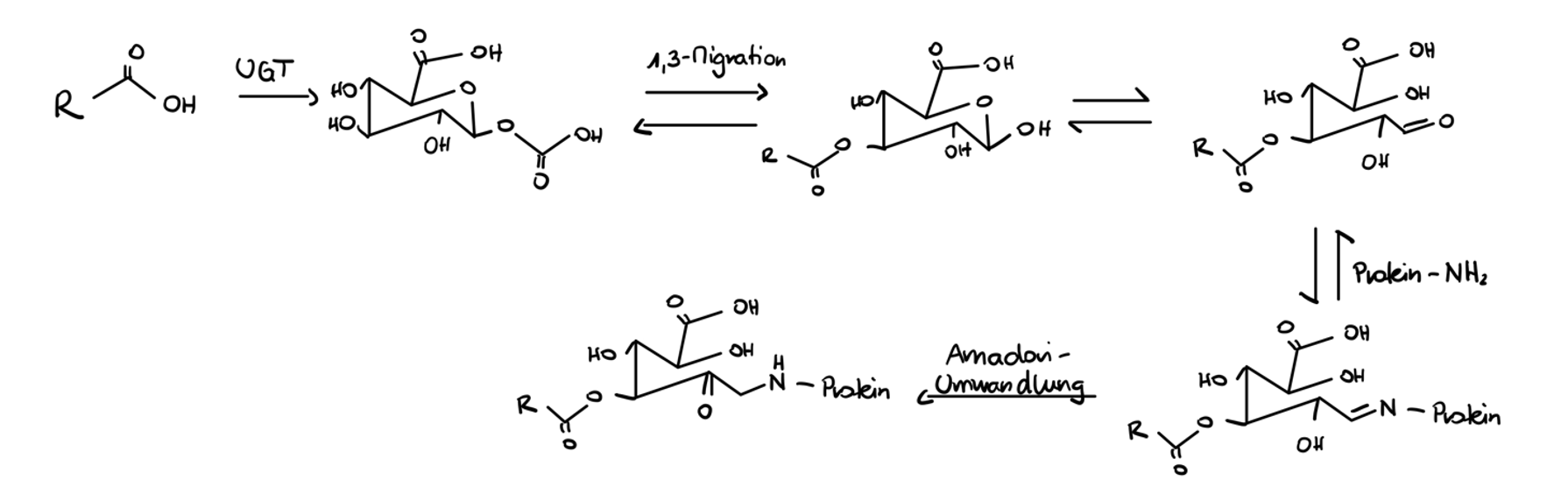
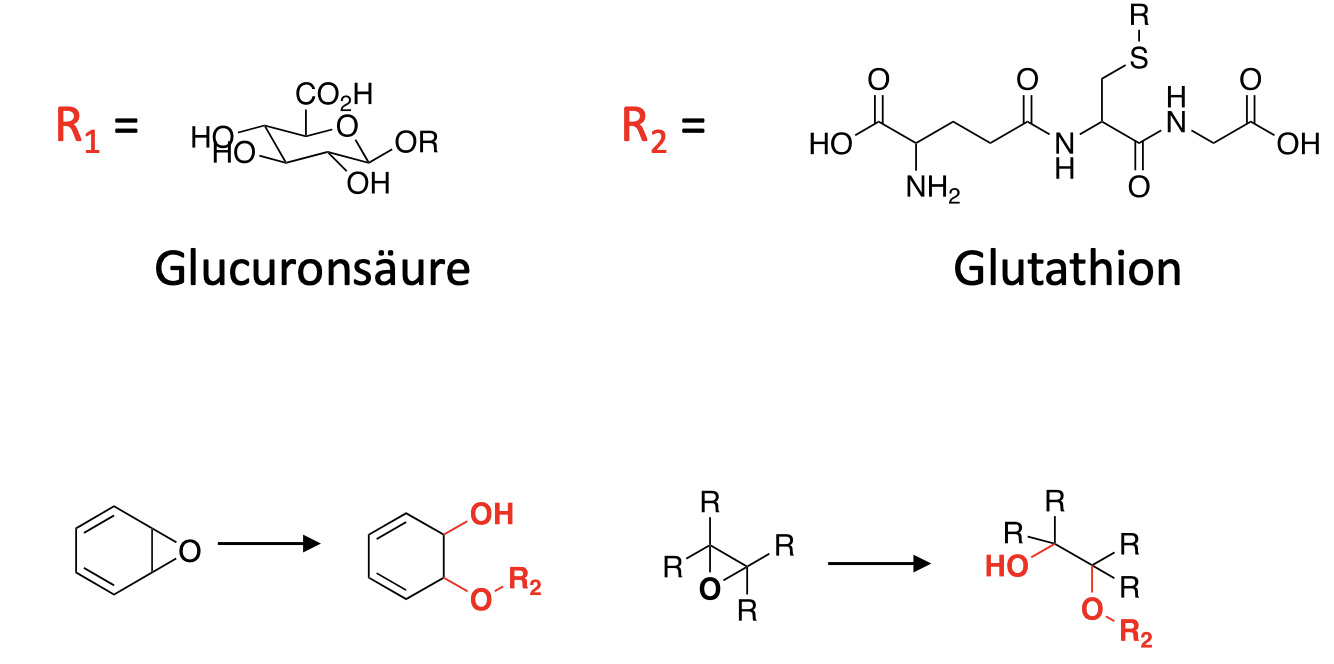
Zeichnen Sie die Glucuronidierung einer Carbonsäure.
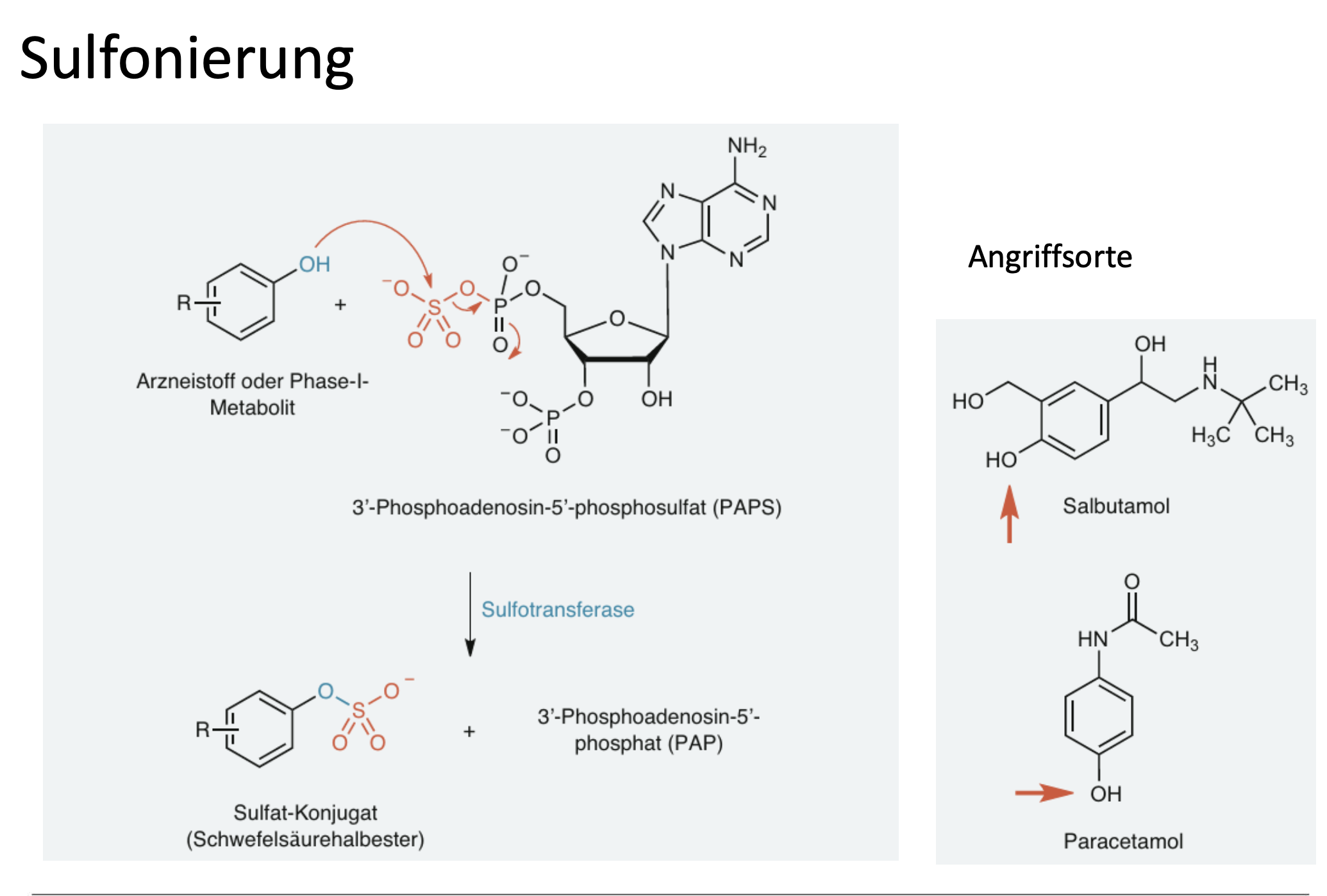
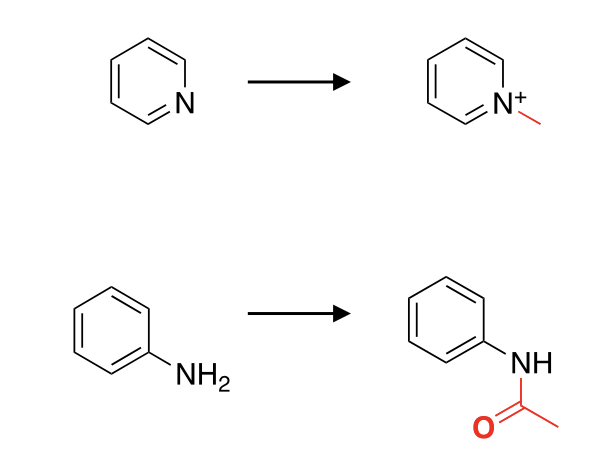
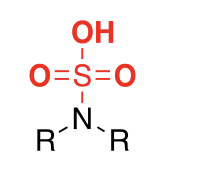
Was gibt es für Angriffsorte für Sulfonierung?
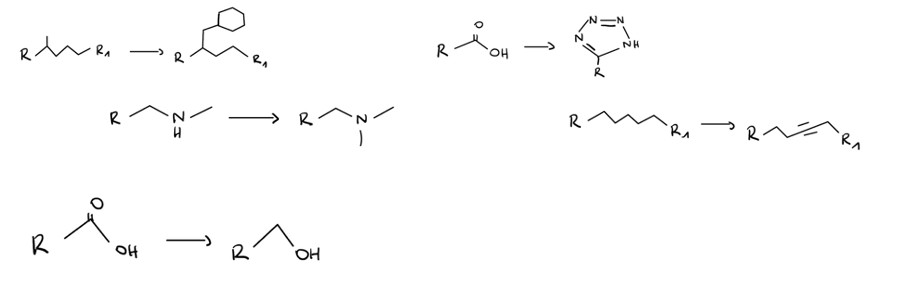
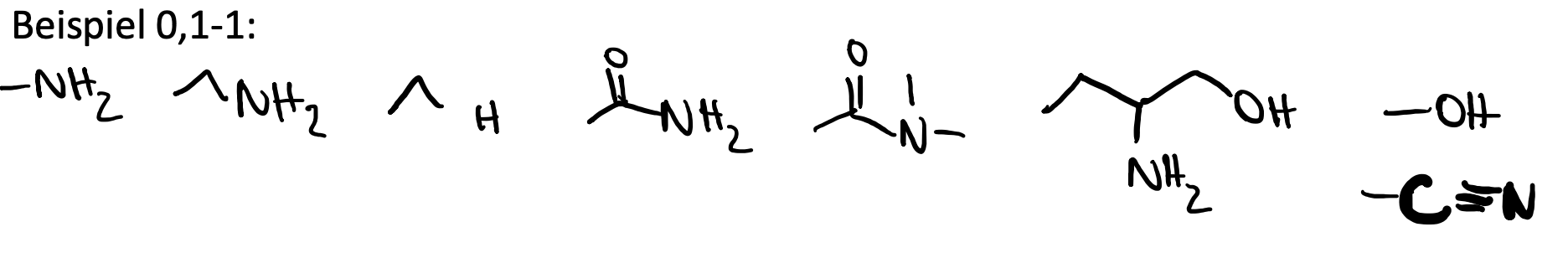
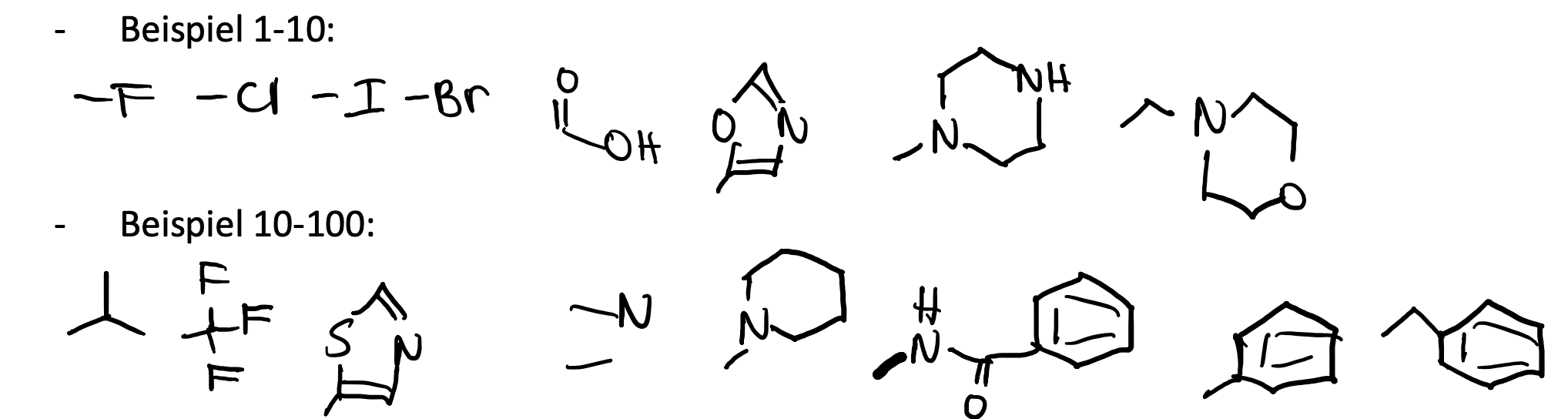
Wie kann man die Permeabilität verbessern? Nennen Sie 5 Möglichkeiten und zeichnen Sie dazu jeweils ein Beispiel.
Wie wichtig ist die Löslichkeit eines Compounds?

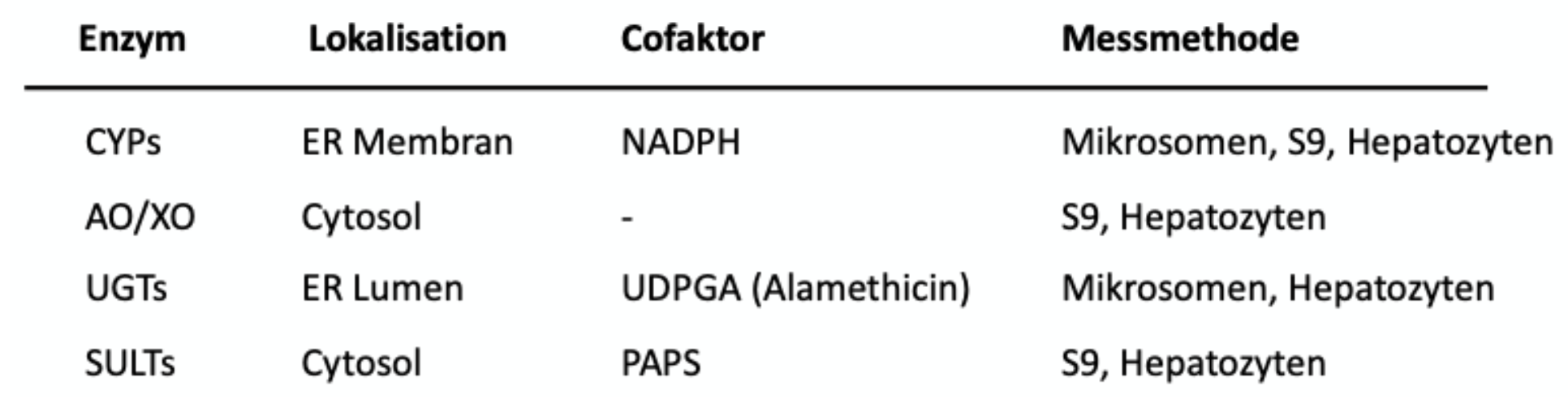
Geben Sie eine Übersicht, wo sich die in der Vorlesung behandelten metabolischen Enzyme in der Zelle befinden, wie Sie den durch sie verursachten metabolischen Turnover experimentell bestimmen können und welche Co-Faktoren Sie gegebenfalls benötigen.
Erklären Sie den Unterschied zwischen Protacs und Molecular Glues.
=innovative Ansätze in der Arzneistoffentwicklung beschrieben, um Proteine gezielt abzubauen, anstatt sie nur zu inhibieren.
=hetero-bifunktionelle Moleküle, die gezielt für den Abbau eines bestimmten Proteins entworfen werden
=kleine Moleküle, die zwei Proteine in räumliche Nähe bringen und so den Abbau eines „Neo-Substrats“ ermöglichen.
Welche Grundstruktur muss für Aldehyd-Oxidasen gegeben sein und welche Grundstruktur muss für Xanthin-Oxidase gegeben sein?
Welche Aspekte sollten Sie miteinbeziehen, wenn Sie die Ergebnisse eines High-Throughput Screenings analysieren?
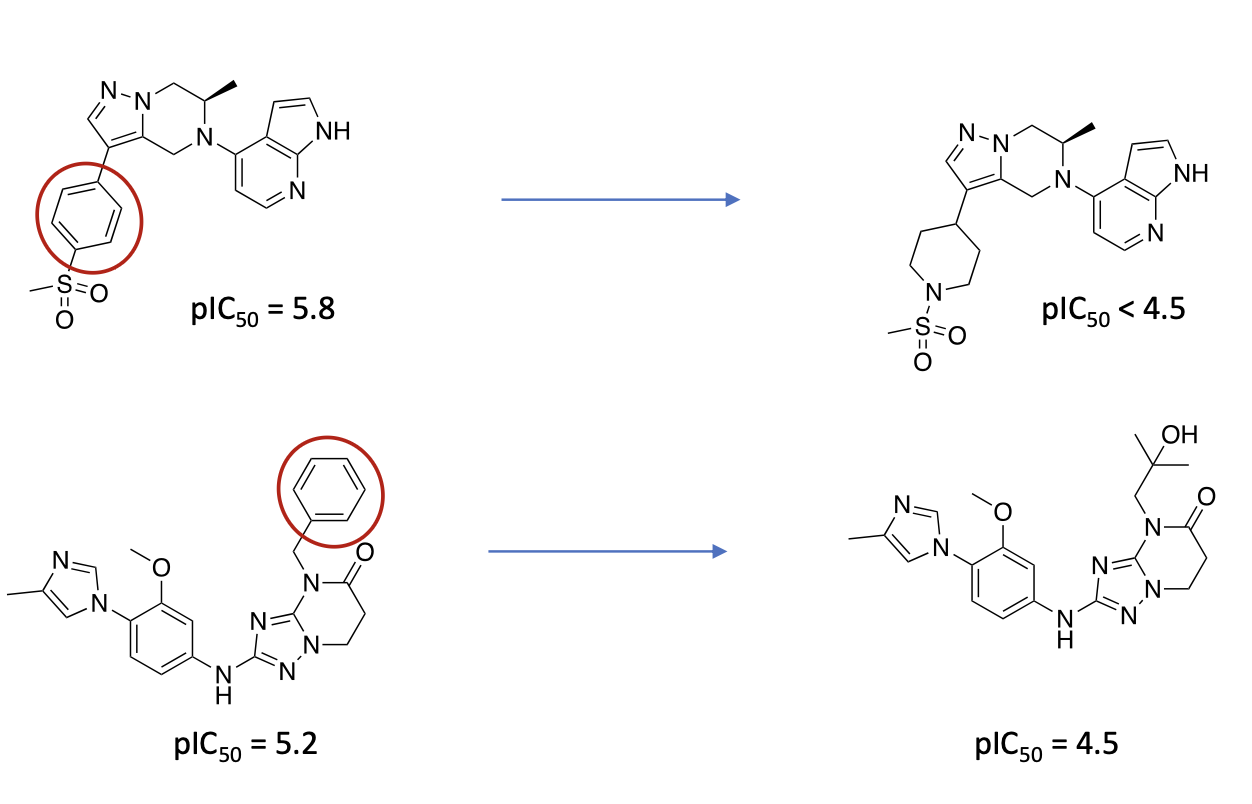
R-Group Analyse und Matched Molekular Pair Analyse: Was versteht man darunter und in welchem Zusammenhang werden sie eingesetzt?
= Methoden, um Struktur-Wirkungs-Beziehung zu entschlüsseln

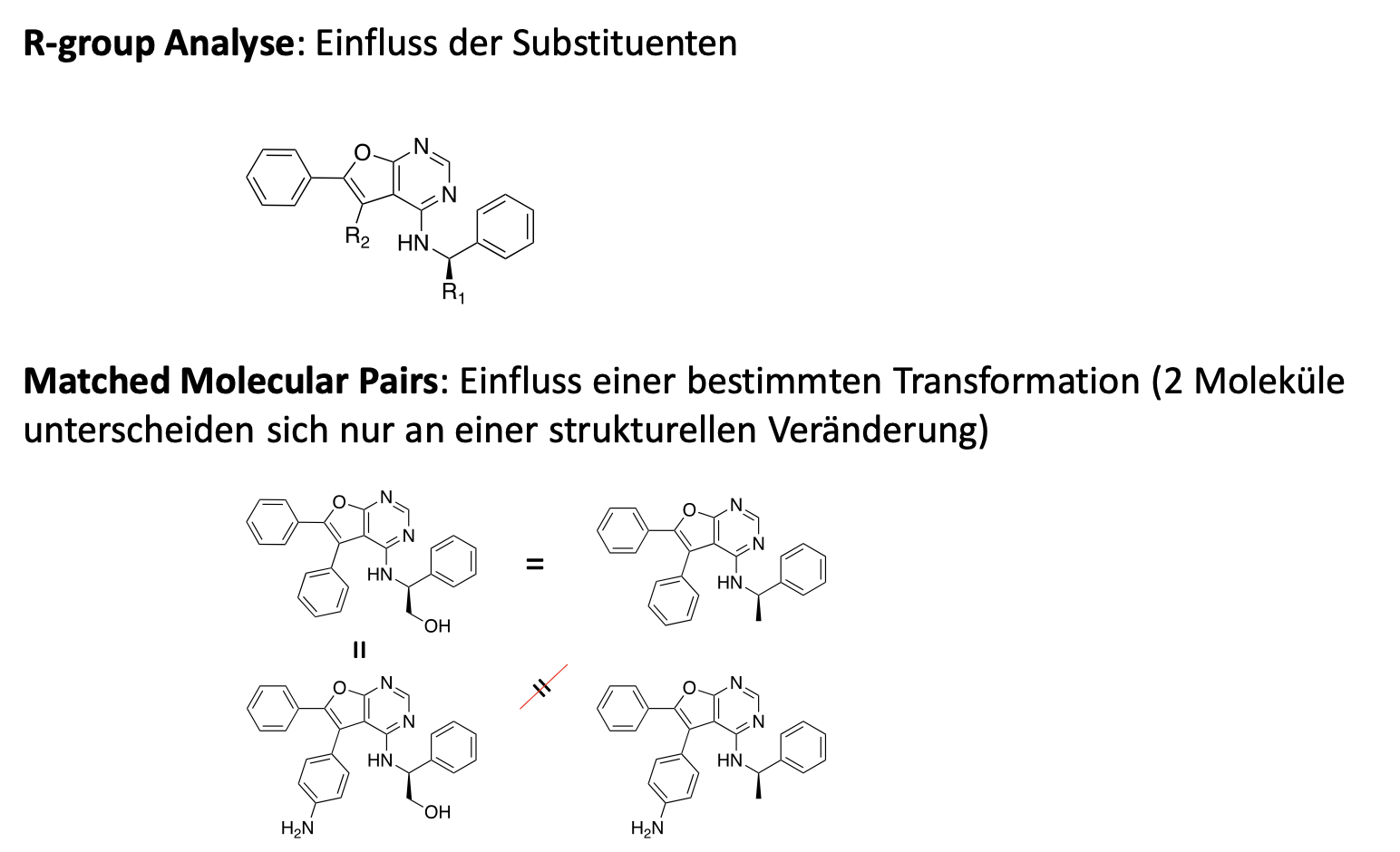
Stellen Sie sich ein Molekül wie ein Gerüst (Scaffold) vor – zum Beispiel ein Haus. Die R-Gruppen sind die Anbauteile wie Fensterläden, Türen oder Blumenkästen. In der Chemie nennt man diese variablen Seitenketten "R-Reste".
Was wird gemacht? Man behält das Grundgerüst des Moleküls bei und tauscht systematisch nur die Seitenketten (R1, R2, R3...) an bestimmten Positionen aus.
Das Ziel: Man möchte herausfinden, welche Kombination von Restgruppen die beste Wirkung erzielt (z. B. "Wenn an Position 1 ein Chlor-Atom sitzt, bindet das Medikament besser").
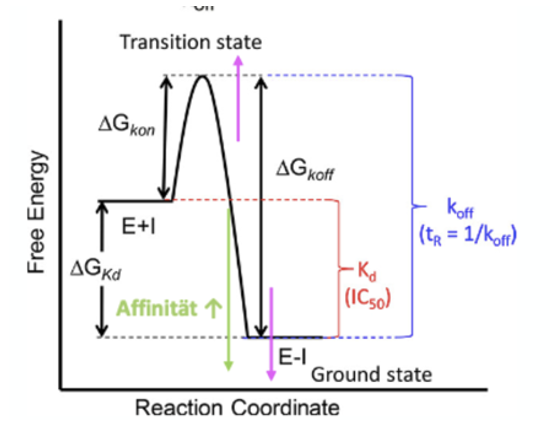
Zeichnen Sie die Reaktionskoordinate für die Liganden-Bindung und zeichnen Sie dort die Energiedifferenz für Affinität, kon und koff ein.
Nenne Sie Modifikationsmöglichkeiten für Keton im Liganden-basierten Design.
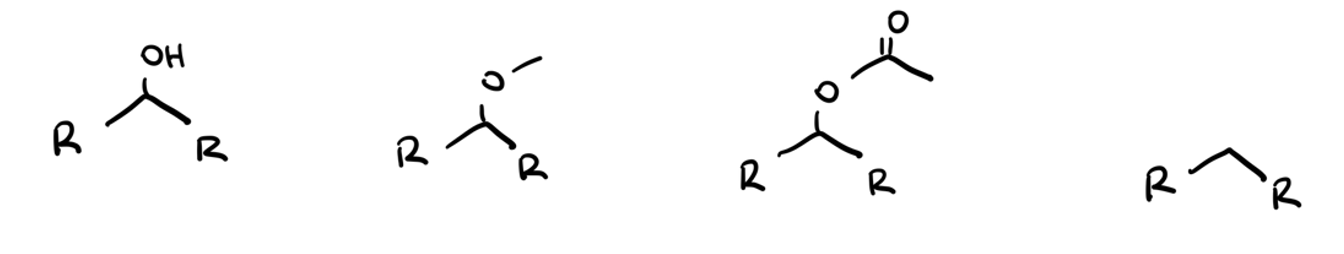
Entropic Penalty erklären und 2 Beispiele nennen, wie man es umgehen kann.
Erklären Sie das phänotypische Screening und was ist hier mit der Rule of Three gemeint? Wo haben Sie noch die Rule of Three kennengelernt und wie lautet sie?
=Methode zur HIT-Identifizierung
Biologie-fokussiertes Screening:
Rule of Three:
Design-Strategien, um hERG-Blockade zu verhindern + Beispiel.
=Es handelt sich dabei um einen spannungsaktivierten Kaliumkanal. Seine wichtigste Aufgabe ist die Repolarisation während eines Aktionspotenzials am Herzen.
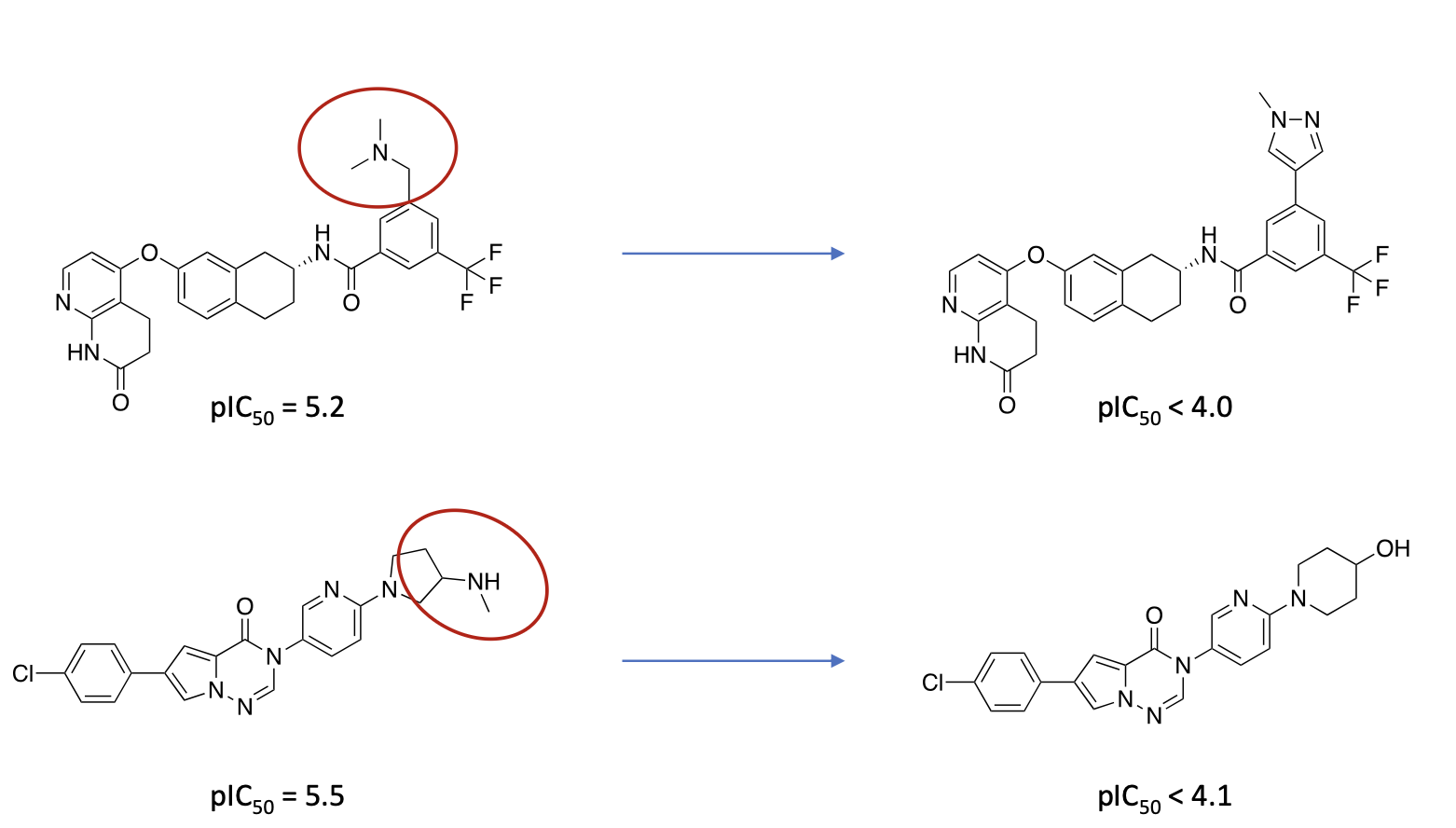
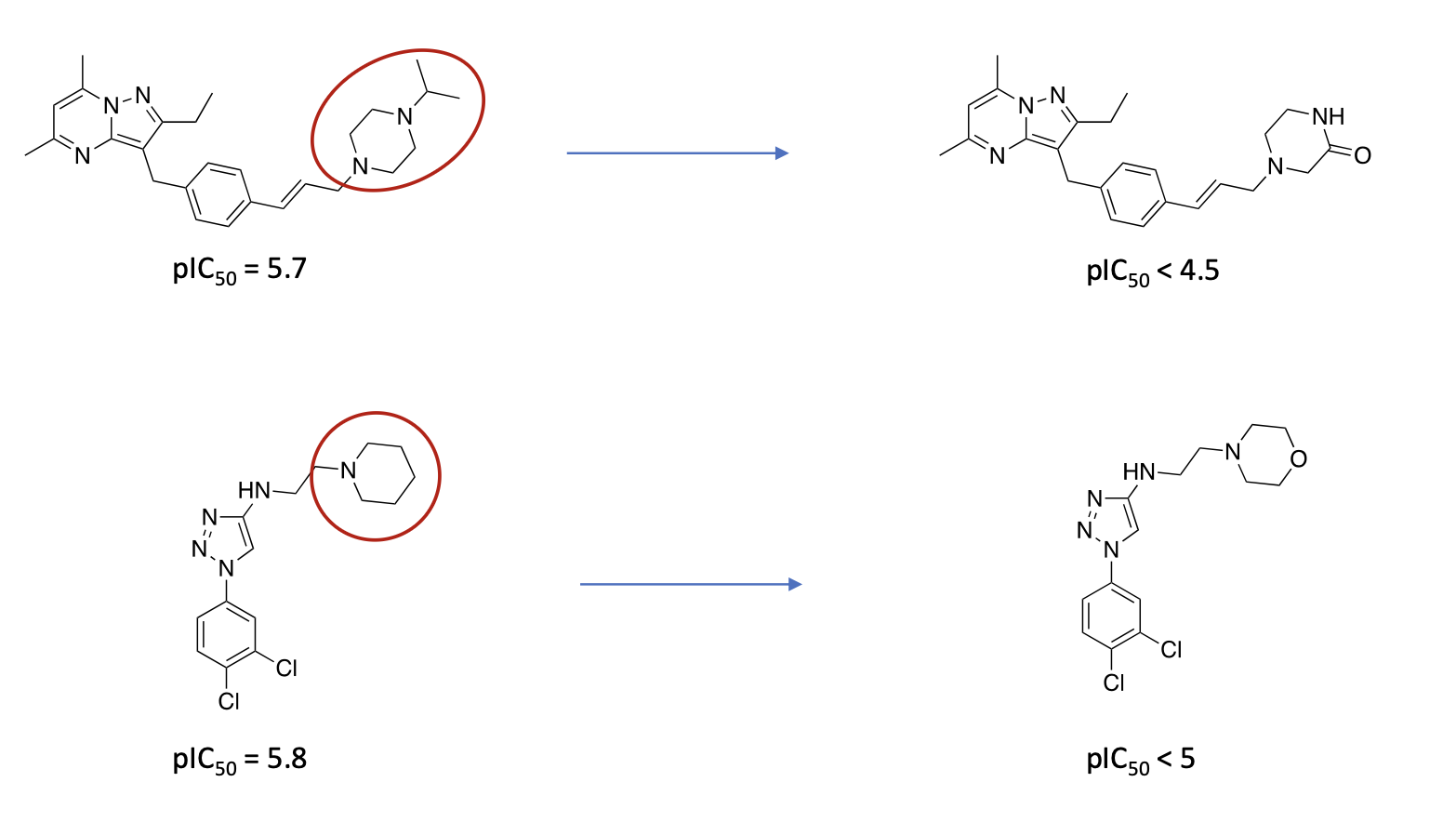
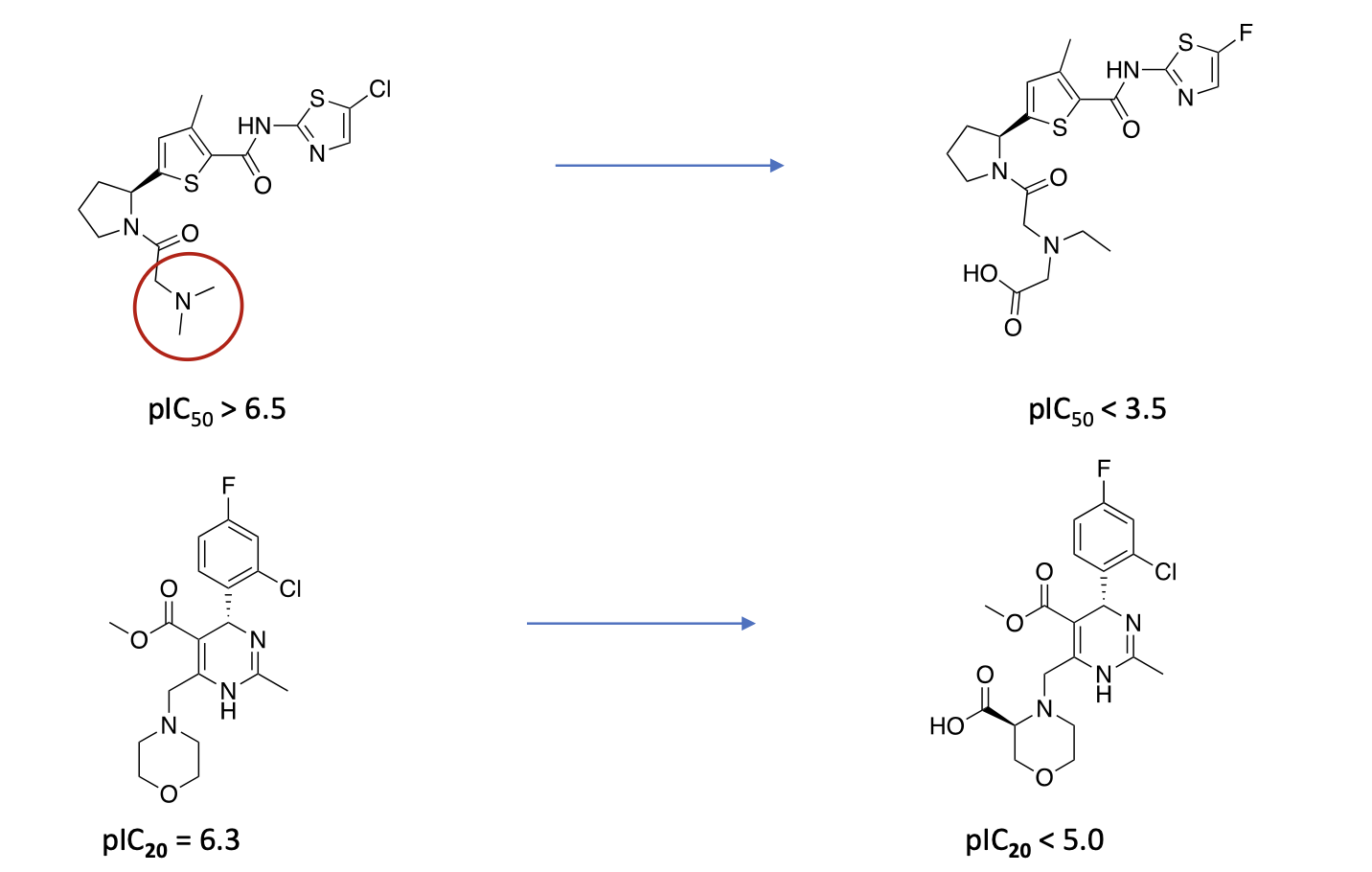
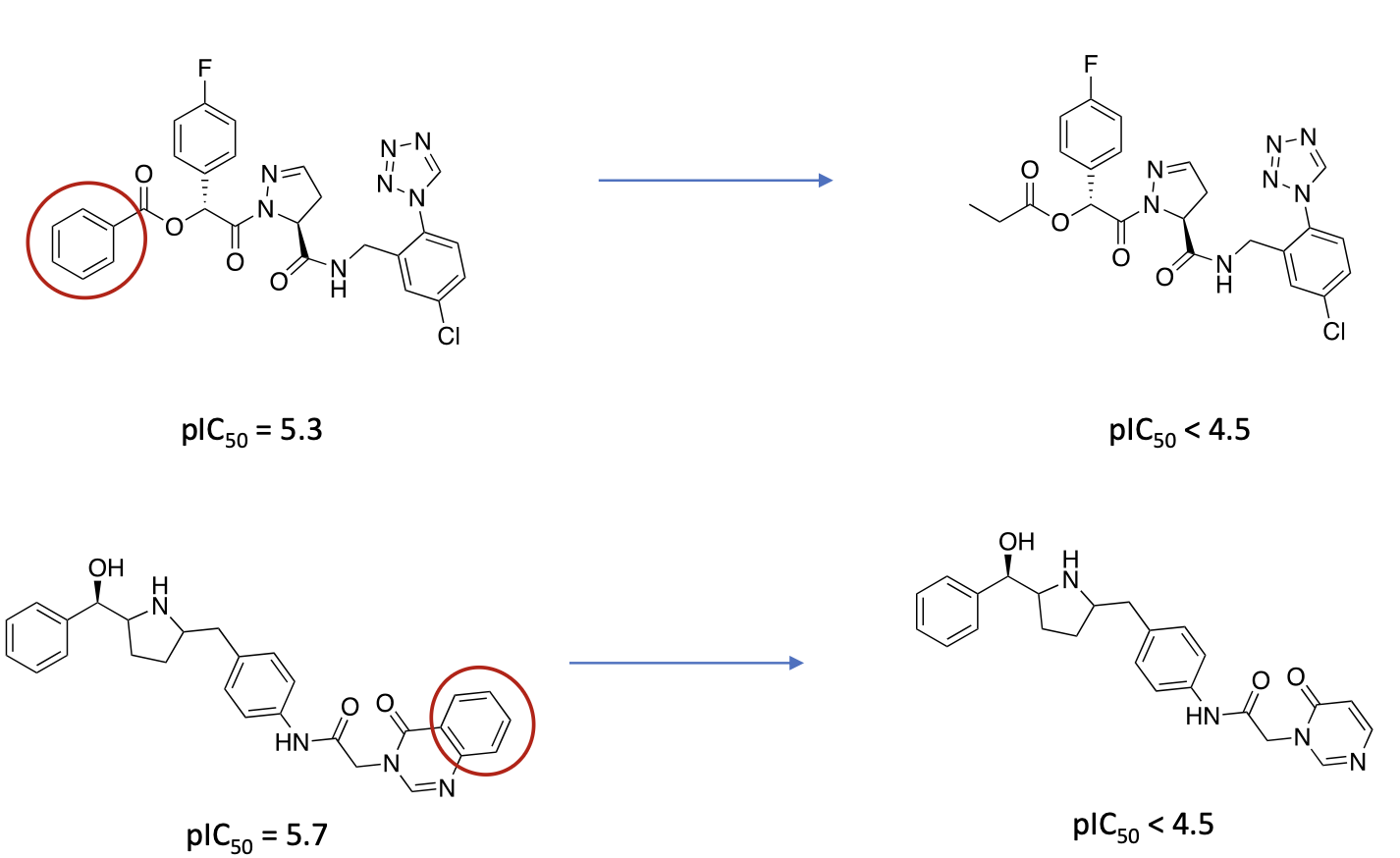
Welche molekularen Ursachen für Genotoxizität kennen Sie?
Erklären Sie anhand jeweils eines Beispiels wie Sie ein Molekül verändern können, um Genotoxizität zu verhindern.
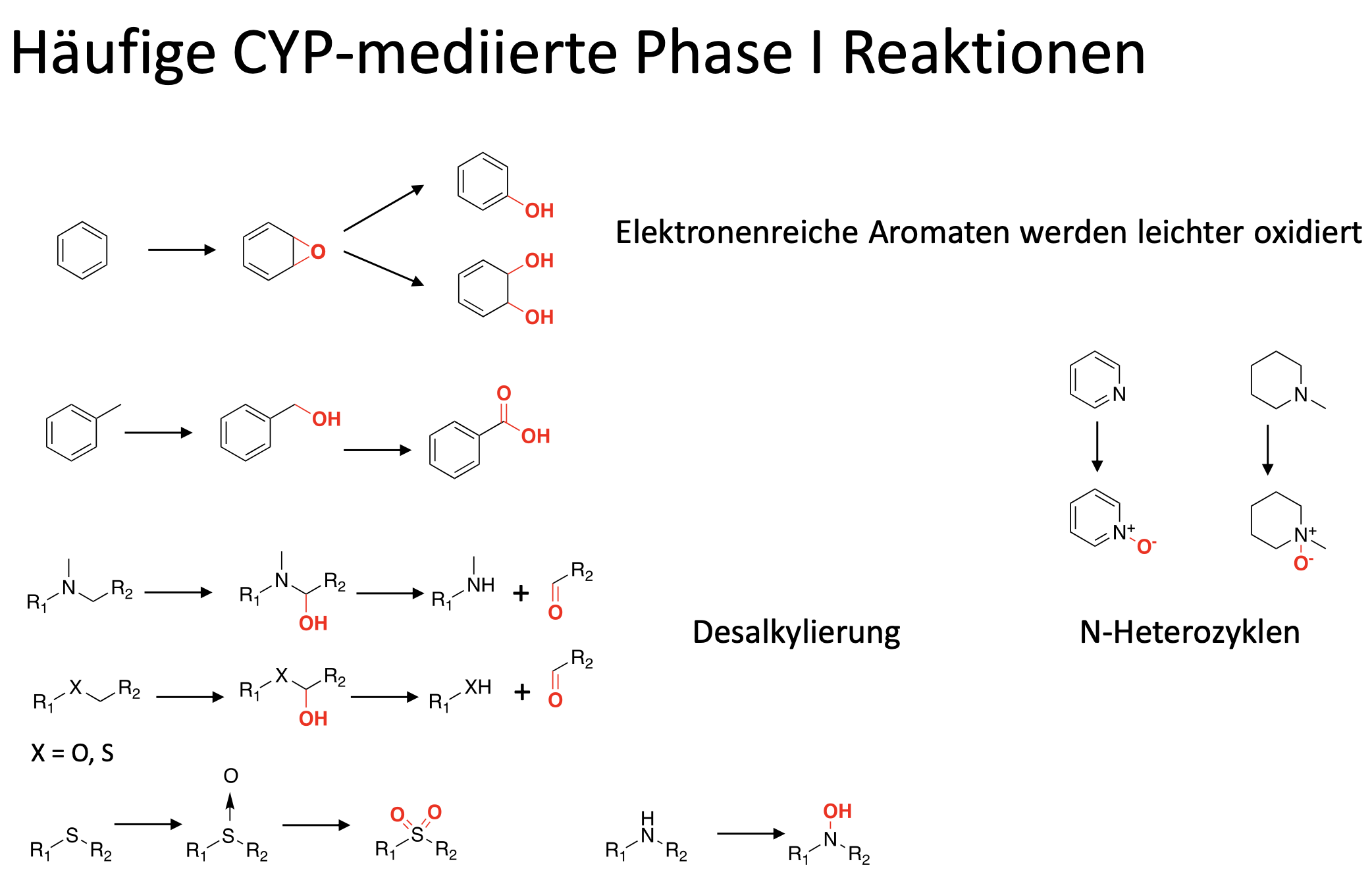
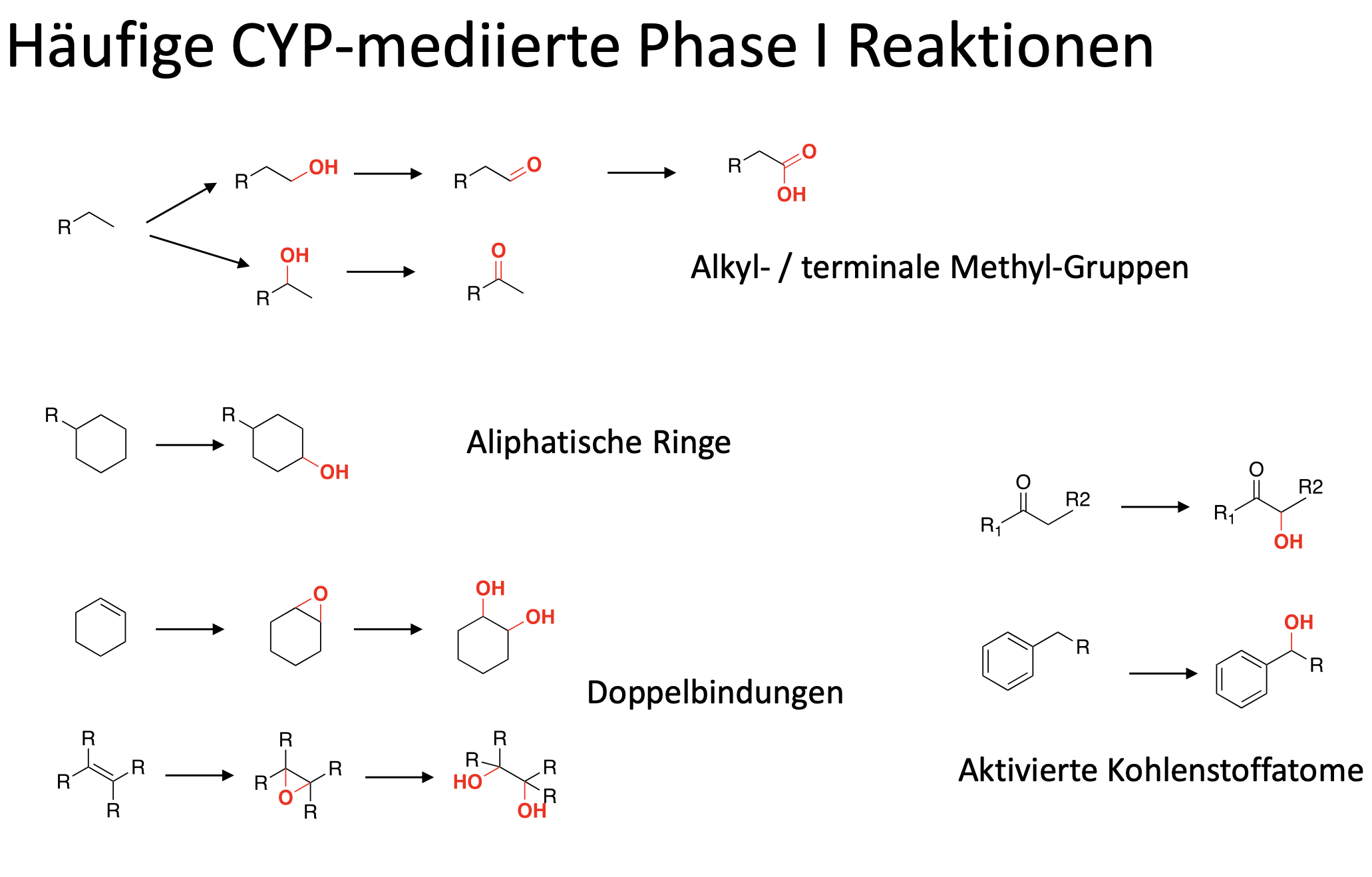
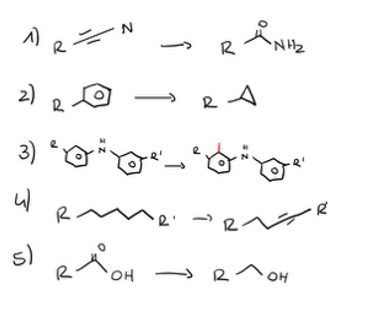
Welche CYP-mediierte Phase 1 Reaktionen gibt es?
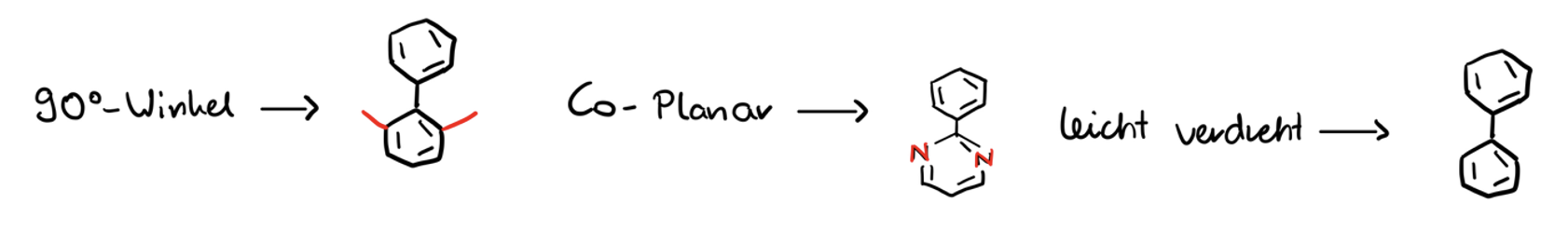
Torsionswinkel von Biphenyl. Mit welchen Substituenten kommt 90° Winkel, Co-Planarität und leichte Drehung zustande?
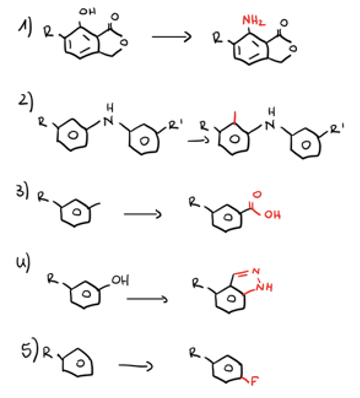
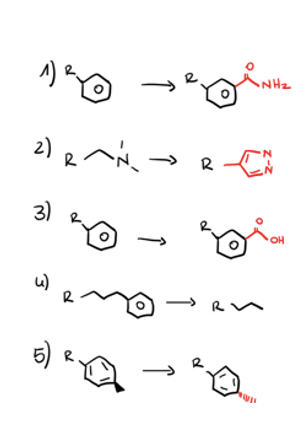
Nennen Sie 3 Design-Strategien, mit denen Sie UGT-mediierten metabolischen Abbau verhindern können. Erklären Sie, warum diese Strategien zu einem verminderten metabolischen Abbau führen sollen und zeichnen Sie für jede Design-Strategie ein Beispiel.
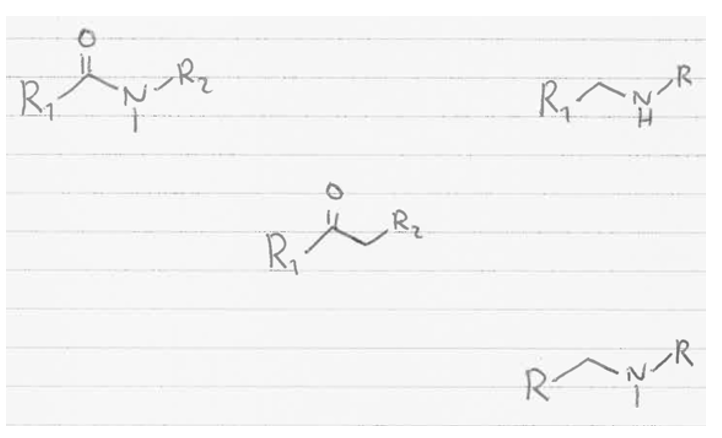
Wie kann man tR berechnen sowie verbessern?

Nenne 5 Methoden zur Löslichkeitsverbesserung (+ Zeichnen)


Amid in Liganden-basierter Optimierung testen, zeichnen Sie 3 mögliche Strukturen.
Welche Arten von Toxizität gibt es?
Nenne 5 Strategien, um den metabolischen Abbau zu minimieren
Welche Arten von Löslichkeit gibt es?

Beschreiben Sie den Unterschied zwischen einem chemischen Tool und einem Arzneistoff.
Polypharmakologie= ein einzelner Wirkstoff wirkt auf viele biologische Ziele im Körper
Welche Fragment follow Ups kennen Sie und erklären Sie kurz, was das ist.
Growing: Fragment wird in Bindetasche eingebaut
Merging: Strukturelemente von zwei Fragmenten, die an die selbe Stelle in der Bindetasche binden, werden kombiniert um ein neues Molekül zu erhalten
Linking: Zwei Fragmente, die an unterschiedlichen Stellen in der Bindetaschen binden, werden mittels eines Linkers zu einem Molekül verbunden
Was sind targeted covalent Inhibitors?
= „Ein Inhibitor, der eine funktionelle Gruppe mit geringer Reaktivität trägt, die nach der Bindung an das Zielprotein so positioniert ist, dass sie schnell mit einem spezifischen Rest (Aminosäureseitenkette) der Zielstelle reagiert.“
Nennen Sie 5 mögliche Ursachen für Assay-Interferenzen im High-Throughput Screening. Wie können Sie das jeweils testen oder umgehen?
Erklären Sie Scaffold Hopping und zählen Sie 5 Vorteile auf.
Vorteile:
Erklären Sie den Einfluss von Lipophilie auf Permeabilität, Löslichkeit, Toxizität und Stabilität!
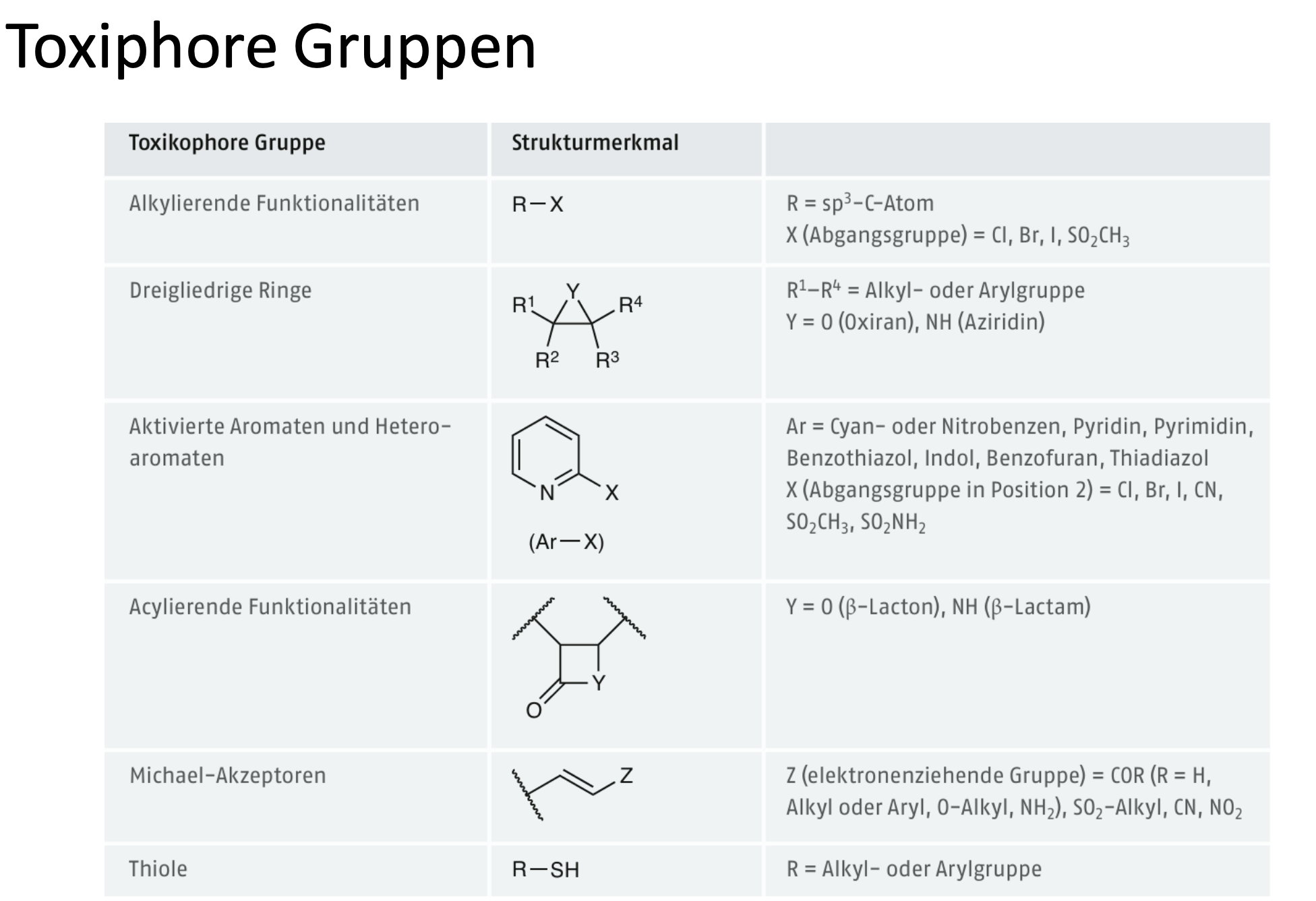
Was für Toxiphore Gruppen gibt es?
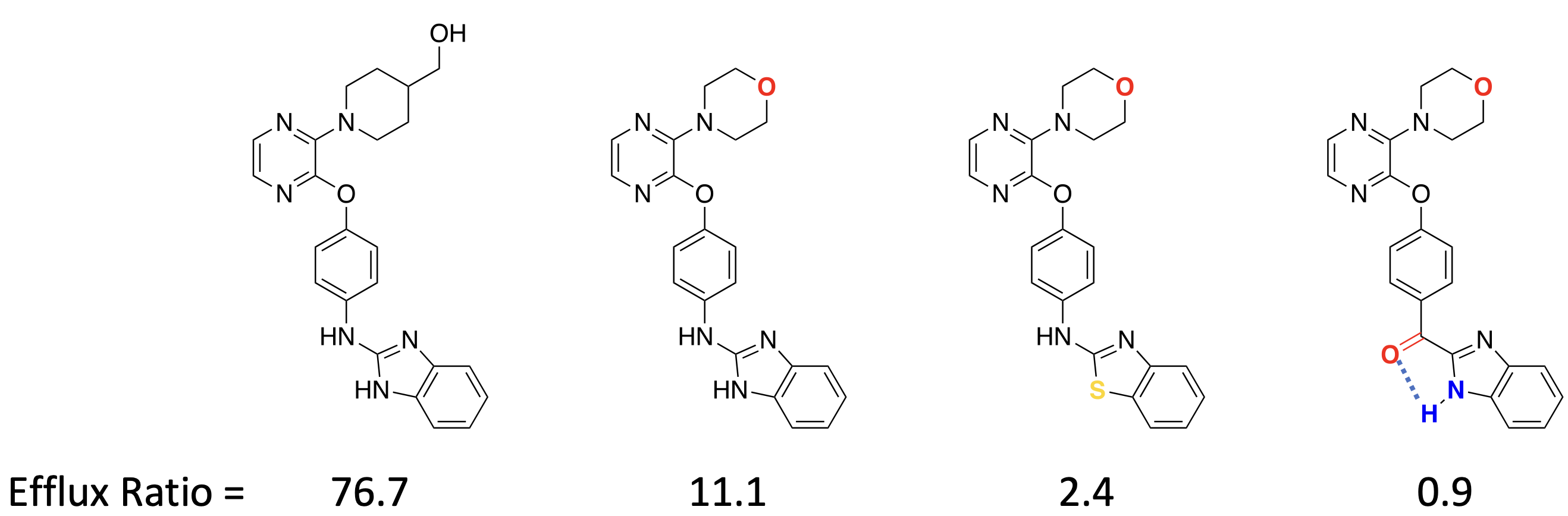
Wie kann die ZNS Gängigkeit minimiert werden?
= Efflux maximieren
PSA= Polar surface Area
Welcher Mechanismus tritt bei einer generellen CYP-Inhibition auf?
N-Heteroaromaten koordinieren Eisen in Häm-Gruppe und blockieren damit das Enzym
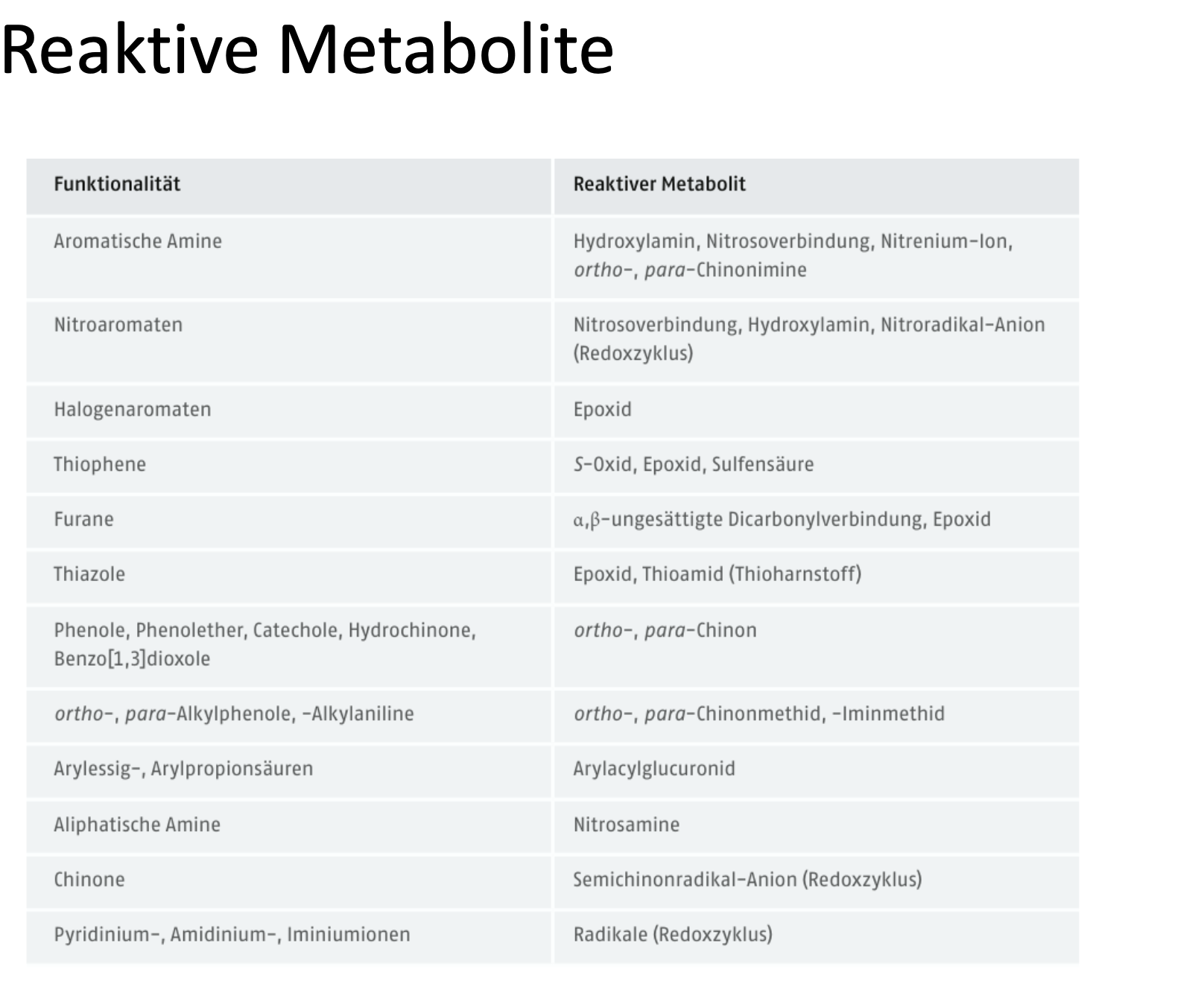
Was für reaktive Metabolite gibt es?
Wie kann man die PXR-Aktivierung verringern? Nennen Sie 5 Beispiele und zeichnen Sie diese auch. Welcher Einfluss hat die PXR-Aktivierung auf den Metabolismus sowie auf den Efflux?
=PXR fungiert als ein nukleärer Rezeptor, der die Genexpression von metabolisierenden Enzymen steuert
=Pregnan-X-Rezeptor
Erkläre Prinzip von DNA Encoded Library
Dies ist eine revolutionäre Methode, um große Substanzmengen gleichzeitig zu testen.
Das Prinzip: Jedes chemische Molekül ist fest mit einem kurzen DNA-Strang verbunden, der wie ein "Barcode" funktioniert.
Vorteil: Man kann Milliarden von verschiedenen Molekülen in einem einzigen Reagenzglas mischen und gegen ein Protein testen. Die Moleküle, die fest binden, werden durch Waschen isoliert.
Identifizierung: Da die Menge des gebundenen Wirkstoffs winzig ist, nutzt man die DNA-Tags: Diese werden mittels PCR vervielfältigt und anschließend sequenziert. So weiß man anhand des DNA-Codes genau, welches Molekül erfolgreich gebunden hat.
Synthese: Die Bibliotheken werden oft nach dem Split-and-Pool-Prinzip hergestellt, wodurch in wenigen Schritten eine enorme Vielfalt entsteht (z. B. 1000 x 1000 Bausteine).
Vorgang:
Was muss bei Target Validierung/Assessment berücksichtigt werden?
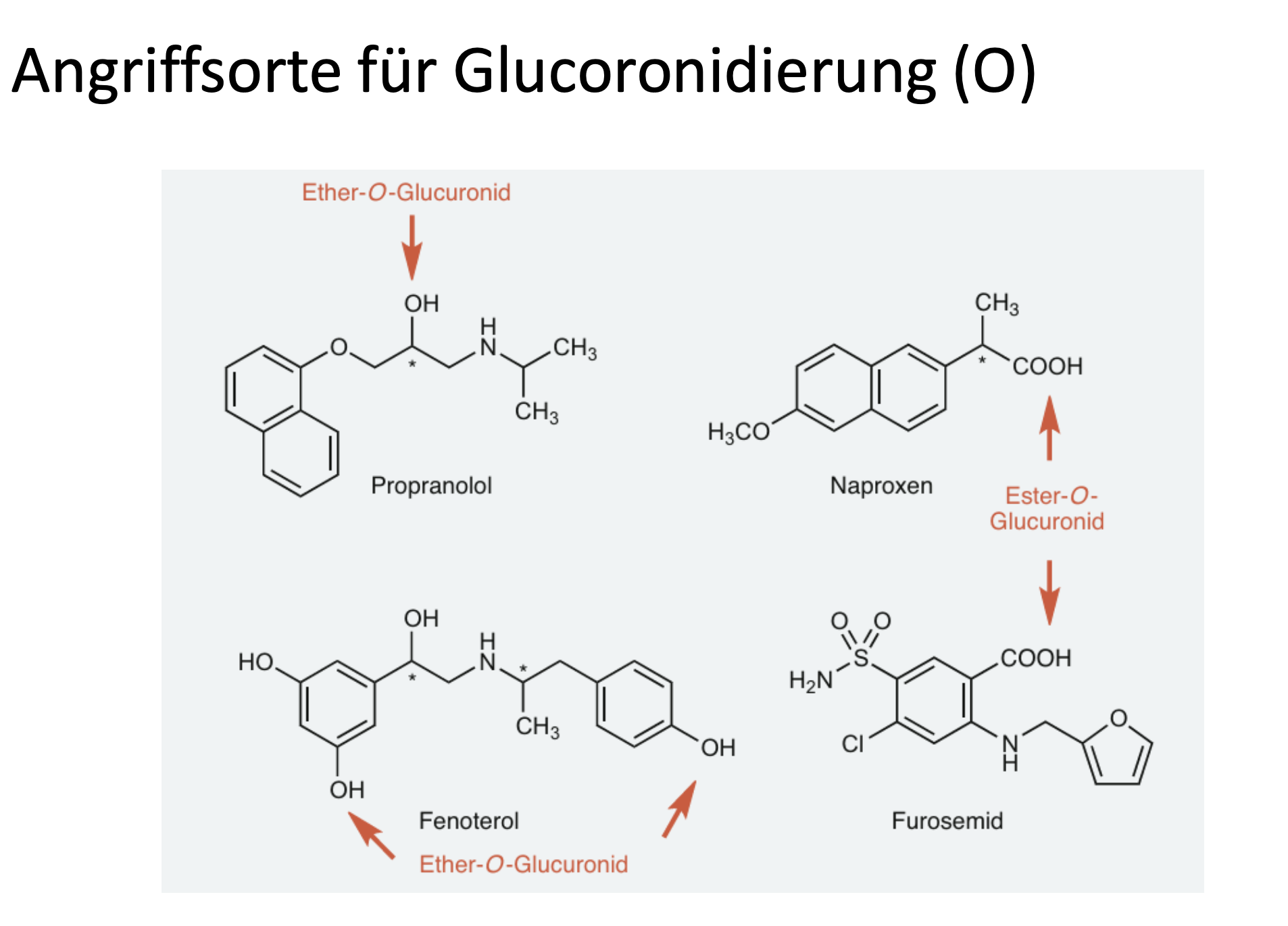
Was gibt es für Angriffsorte für Glucuronidierung beim O?
Wie können Sie überprüfen, ob eine Verunreinigung bei Ihrem Assay interferiert?
Welche Eigenschaften besitzen hERG-Blocker? Nennen Sie 5 Strategien, um die hERG-Blockade zu verhindern, sowie jeweils ein Beispiel dazu!
Welche Informationen erhalten Sie von einer Wasser-Analyse im Strukturbasierten Liganden-Design und wie können Sie das für die Optimierung von Molekülen verwenden?
Häufige Phase 2 Reaktionen
Virtuelles Screening und welche 3 Methoden gibt es.
Welche Experimente werden im High Throughput Screening durchgeführt, um Hits zu validieren?
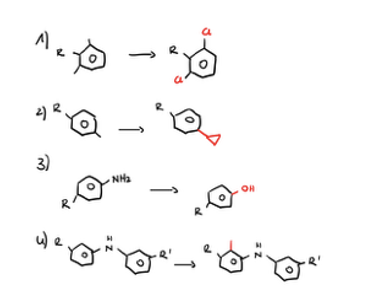
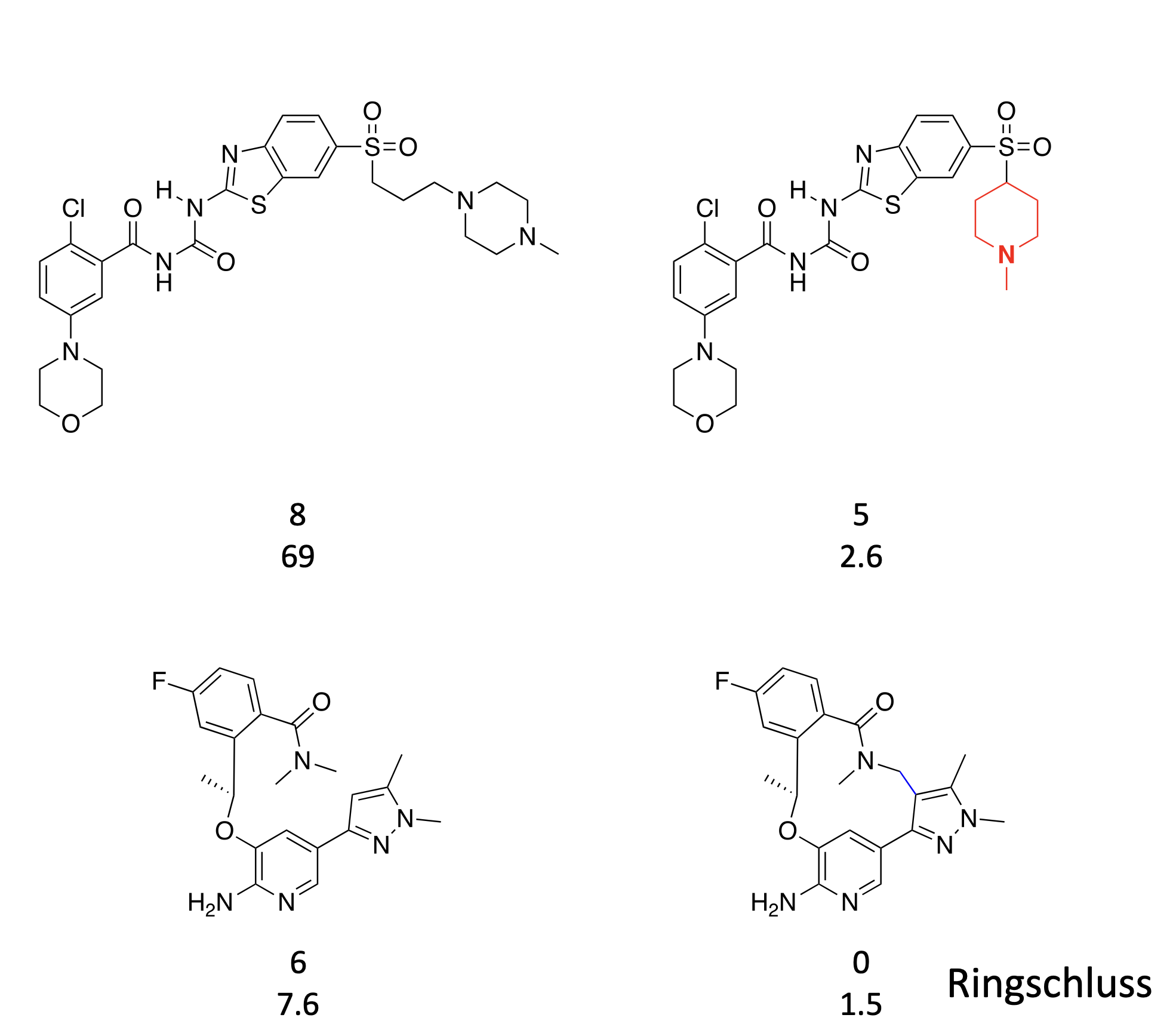
Welche Design-Strategie kennen Sie, um die Konformation eines Moleküls zu beeinflussen?
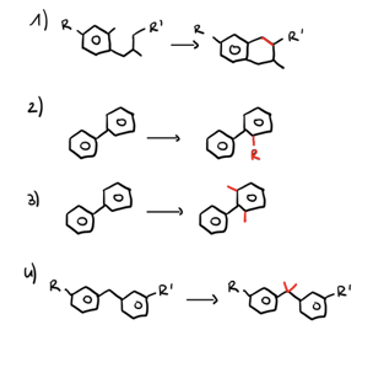
Was versteht man primär unter Scaffold hopping?
Welche Ziele verfolgen wir beim Scaffold hopping?
Wie kann ZNS Gängigkeit maximiert werden?
= Efflux-Ratio senken
Welche Ligand Efficiency Metrics kennen Sie?
Ligand Efficiency (LE): Setzt die Wirksamkeit eines Moleküls in Relation zu seiner Größe —> Anzahl der heavy atoms (nicht Wasserstoff-Atome)
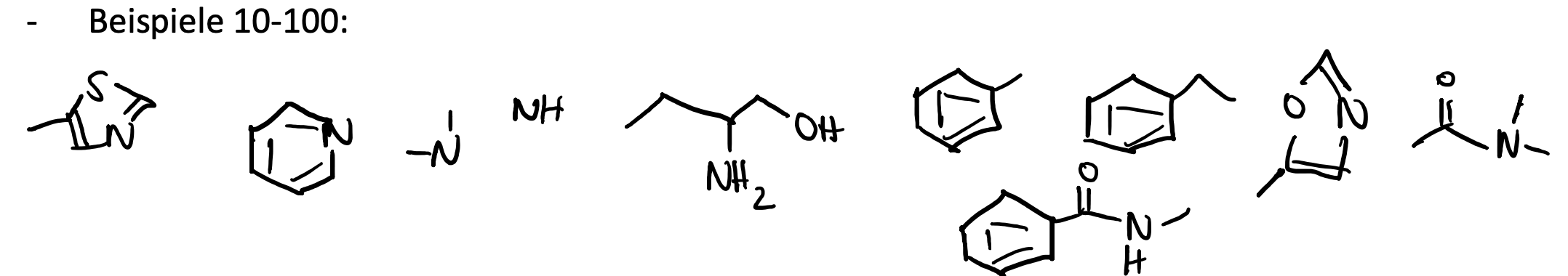
Lipophilic Ligand Efficiency (LLE): setzt Wirksamkeit in Relation mit Lipophilie
Erklären Sie die Entropie-Enthalpie-Compensation sowie die Cooperativity.
Zeichnen Sie die Modifikationsvorschläge für die Untersuchung einer Hydroxy-Gruppe im Ligande-basierten Design.
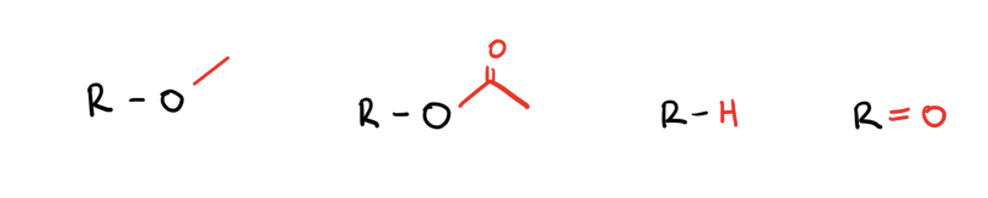
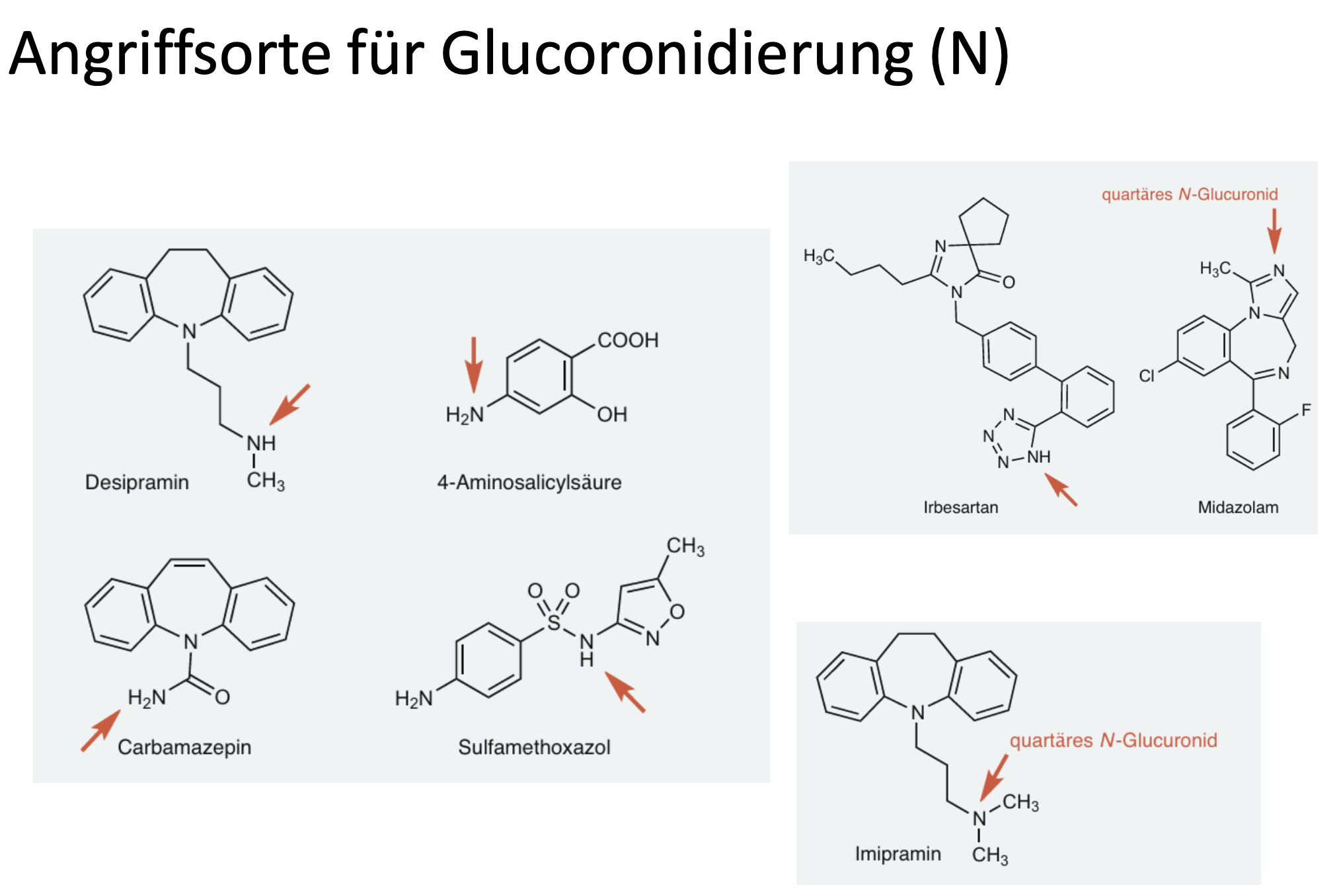
Was gibt es für Angriffsorte für Glucuronidierung beim N?