Reaktionen AC OC II (ETHZ 2. Semester)
Einige Reaktion zum Auswendig lernen aus der Vorlesung AC OC II
Einige Reaktion zum Auswendig lernen aus der Vorlesung AC OC II
Hydroxyalkylierung (El. ar. Subst.)
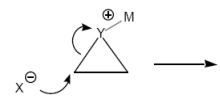
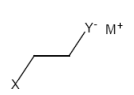
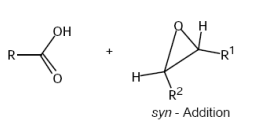
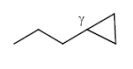
Nucleophile Öffnung von Dreiringen (Nucleophile Subst.)
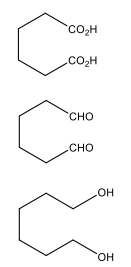
Bsp:
Mehrfache Friedel-Craft-Alkylierungen (El. ar. Subst.)
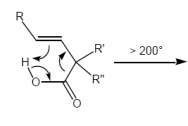
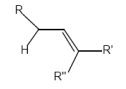
Decarboxylierung von ungesättigten Carbonsäuren
Substitution am Pyridin-Ring, findet immer an Position 3 statt (El. ar. Subst.)
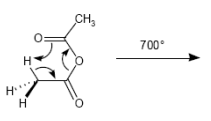
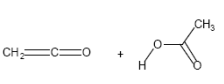
Pyrolyse von Acetanhydriden
Friedel-Craft-Alkylierung (El. ar. Subst.)
Friedel-Craft-Acylierung (El. ar. Subst.)
(Allgemeine Reaktanden: Aromat + Säurehalogenid oder Säureanhydrid + Lewis-Säure / Alles in einem polaren LM)
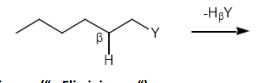
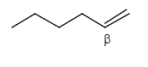
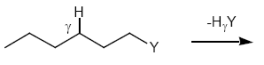
1,2-Eliminierung
Kolbe-Schmitt-Synthese
Bemerkung: Ansatt Fe kann auch Zn oder Sn verwendet werden und anstatt HOAc kann auch eine andere Säure verwendet werden.
Reduktion von Nitrogruppen in (nach Zugabe einer Base) Aminogruppen (Aniline)
(El. ar. Subst.)
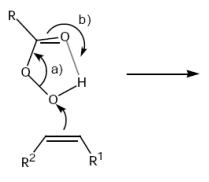
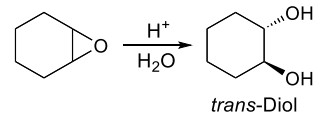
Oberes Molekül: Persäure
Epoxidierung (El. Add. an DB)
Fragmentierung von Radikalen:
Eliminierung eines stabilen Bruchstücks unter Ausbildung eines neuen Radikals
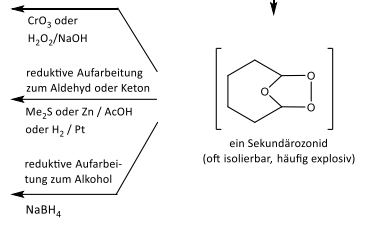
Ozonolyse, Teil 2 (El. Add. an DB)
Vilsmeier-Haack-Formylierung (El. ar. Subst.)
Wichtig: Reaktion funktioniert nur mit stark aktivierten Aromaten!
Friedel-Craft-Alkylierung (El ar. Subst.)
(Reaktanden allgemein: Aromat + Alkylhalogenid + Lewis-Säure)
Achtung! Die Abbildung ist nicht das einzige Produkt. Der Aromat mit zunehmender Alkylierung stärker aktiviert (sigma-donor-Effekt), daher geschehen oft mehrfach-Alkylierungen.
Bei einem deaktivierten Ring funktioniert die Reaktion nicht.
Sandmeyer-Reaktion (El. ar. Subst.)
Substitution an Indol, findet an Position 3 statt. (El. ar. Subst.)
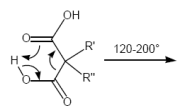
Decarboxylierung von Dicarbonsäuren
Bemerkung: NaNO2 und HX in Wasser erzeugt HNO2
Diazotierung von aromatischen Aminoverbindungen (Anilinen)
(El. ar. Subst.)
Reduktion von Diazoniumsalzen zu ArH (El ar. Subst.)
3. MeI
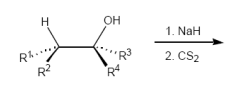
Temp: 100 - 200 Grad
Tschugaeff-Eliminierung
Reduktion von Diazoniumsalzen zu Arylhydrazinen (El. ar. Subst.)
1,3-Eliminierung
Clemmensen Reduktion (kann als Alternative zur Friedel-Crafts-Alkylierung verwendet werden)
(El. ar. Subs.t)
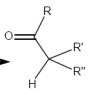 ¨
¨
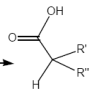
Decarboxylierung von Ketosäuren
Gattermann-Koch-Reaktion (El. ar. Subst.)
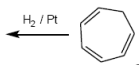
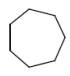
Hydrierung von Alkenen
Ein Diazonium-Salz (Siehe Diazotierung)
Sandmeyer-Reaktion (El. ar. Subst.)
Radikale können Wasserstoffradikale aus dem Lösungsmittel abstrahieren (Hier: THF als LM)
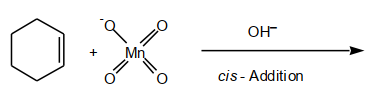
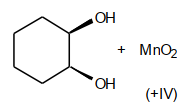
Cis-Dihydroxylierung (El. Add. an DB)
Wolff-Kishner-Reduktion (Als Alternative zu Friedel-Crafts-Alkylierung)
(El. Ar. subst.)
Diazokupplung, funktioniert nur bei stark aktiverten Aromaten ( R muss hohe Elektronendichte im Ring erzeugen können)
(El. Ar. Subst.)
Oxidation von Alkylsubstituenten (Funktioniert mit jeglichen primären und sekundären Alkylsubstituenten) (El. ar. Subst.)
Ein Radikal kann aus einem Zweiten ein Wasserstoffradikal abstrahieren. Das Radikal, dem ein Wasserstoffradikal abstrahiert wird, bildet eine Doppelbindung aus.
Nitrierung
(El. ar. Subst.)
Achtung: H2SO4 in konzentrierter Form wird manchmal auch als "Oleum" bezeichnet oder auch als H2SO4/ SO3
Sulfonierung
(El. ar. Subst.)
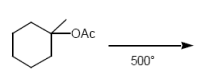
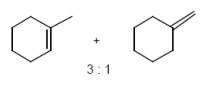
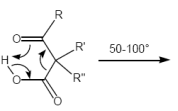
Estherpyrolyse (Eliminierungsrkt.)
Nebenprodukt: Essigsäure
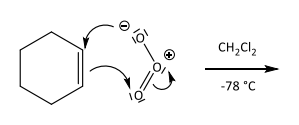
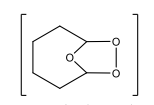
Ozonolyse, Teil 1 (El. Add an DB)
Ozonolyse: Immer O3 + Chloroform + -78 Grad C
Substitution am Pyrrol-Ring, findet aufgrund günstiger Grenzstrukturen an Position 2 statt. Analog für Furan und Thiophen. (El. ar. Subst.)
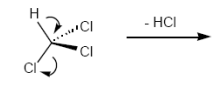
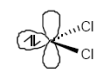
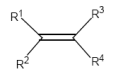
1,1-Eliminierung
Addition an eine Doppelbindung unter Ausbildung eines neuen Radikals
Zwei Radikale können zu einem stabilen Molekül dimerisieren.
Chlorierung (Für Br und I analog, aber nicht für Fluor!)
(El. ar. Subst.)
Schiemann-Reaktion, ermöglicht Fluorierung von Aromaten (El. ar. Subst.)
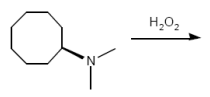
Temp: 120 Grad C
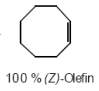
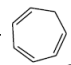
Cyclische Eliminierung nach Cope
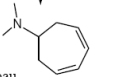

+ KOH
Hofmann-Abbau
Verkochen von Diazoniumsalzen, erzeugt Phenole (El. ar. Subst.)